摘要:(1)实验室加热高锰酸钾制O2的化学方程式为 .应选择的发生装置是 ,收集装置是 . (2)实验室制CO2的化学方程式为 .应选择的收集装置是 .(3)已知过氧化氢无色溶液(溶质为H2O2)常温下在二氧化锰作催化剂的条件下反应可生成水和氧气.写出此反应的化学方程式 .实验室若用此法制取氧气.应选择的发生装置是 .
网址:http://m.1010jiajiao.com/timu_id_883033[举报]
实验室现有高锰酸钾、30%双氧水、二氧化锰、浓硫酸、稀盐酸、大理石及以下仪器:
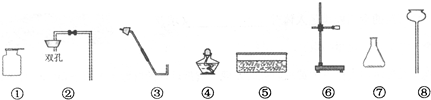
(1)利用上述仪器及药品制取该气体的化学方程式为
请在方框内画出制取该气体的装置图:

(2)简要说明你组装的气体发生装置的优点
(3)若在上述实验药品中把一种液体药品进行适当稀释,就能制取另一种气体,则反应的化学方程式为:
查看习题详情和答案>>

(1)利用上述仪器及药品制取该气体的化学方程式为
CaCO3+2HCl=CaCl2+H2O+CO2↑
CaCO3+2HCl=CaCl2+H2O+CO2↑
.请在方框内画出制取该气体的装置图:

(2)简要说明你组装的气体发生装置的优点
不需加热,节约能源(或方便加液体药品)
不需加热,节约能源(或方便加液体药品)
. (答出一点即可)(3)若在上述实验药品中把一种液体药品进行适当稀释,就能制取另一种气体,则反应的化学方程式为:
2H2O2
2H2O+O2↑
| ||
2H2O2
2H2O+O2↑
.
| ||
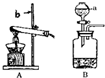 实验室常用高锰酸钾粉末制取氧气(装置A),也可以用过氧化氢溶液和催化剂二氧化锰来制取氧气(装置B).
实验室常用高锰酸钾粉末制取氧气(装置A),也可以用过氧化氢溶液和催化剂二氧化锰来制取氧气(装置B).(1)写出实验室用双氧水和二氧化锰混合制取氧气的化学方程式:
2H2O2
2H2O+O2↑
| ||
2H2O2
2H2O+O2↑
| ||
(2)装置A中应在试管口放
一团蓬松的棉花
一团蓬松的棉花
,以防高锰酸钾粉末进入导管.(3)如果装置B中的反应很剧烈,应该采取的安全措施是
暂时关闭分液漏斗的活塞或减缓滴加速度
暂时关闭分液漏斗的活塞或减缓滴加速度
.(4)用A装置制备气体应考虑的因素是
反应物的状态和反应条件(或是否是固固加热型)
反应物的状态和反应条件(或是否是固固加热型)
.(5)小明同学用
B
B
装置(填“A”或“B”)可以制取二氧化碳,写出实验室制取二氧化碳的化学方程式CaCO3+2HCl═CaCl2+H2O+CO2↑
CaCO3+2HCl═CaCl2+H2O+CO2↑
.(6)生产硫酸的工厂,常用氢氧化钠溶液处理工厂排放出的废液.若用去溶质质量分数为15%的氢氧化钠溶液40g,则中和废硫酸中所含的硫酸的质量为多少g?
解:设中和废硫酸所含硫酸的质量为x
H2SO4+2NaOH═Na2SO4+2H2O
9880
x40g×15%
=
解得:x=7.35g
答:中和废硫酸所含硫酸的质量为7.35g
H2SO4+2NaOH═Na2SO4+2H2O
9880
x40g×15%
| 98 |
| 80 |
| x |
| 40g×15% |
解得:x=7.35g
答:中和废硫酸所含硫酸的质量为7.35g
解:设中和废硫酸所含硫酸的质量为x
H2SO4+2NaOH═Na2SO4+2H2O
9880
x40g×15%
=
解得:x=7.35g
答:中和废硫酸所含硫酸的质量为7.35g
.H2SO4+2NaOH═Na2SO4+2H2O
9880
x40g×15%
| 98 |
| 80 |
| x |
| 40g×15% |
解得:x=7.35g
答:中和废硫酸所含硫酸的质量为7.35g
高锰酸钾可以杀灭细菌,是家庭必备的常用消毒药.已知:K2MnO4溶液为绿色溶液.
KMnO4的制取:
实验室制取KMnO4的方法和步骤是①高温灼烧MnO2、KOH等获得K2MnO4固体②用适量热蒸馏水溶解K2MnO4③加热K2MnO4溶液并缓慢通入CO2,反应生成KMnO4、K2CO3和MnO2④悬浊液经过滤,…,低温烘干,最终制得高锰酸钾晶体.
(1)步骤②中用热蒸馏水溶解的目的是 ,步骤③中获取KMnO4的化学方程式是 .步骤④中高锰酸钾晶体只能低温烘干的原因是 .
(2)带孔隔板上的块状固体是 ,从长颈漏斗中加入的溶液是 .
(3)实验操作是先打开K3、K2,关闭K1、K4,稍打开玻璃活塞,缓慢 通入CO2,未反应的CO2被气囊A收集.一段时间后,关闭玻璃活塞,打开K1、K3、K4,关闭K2,缓慢挤压气囊A将CO2排到反应液中,未反应的CO2被气囊B收集,打开K1、K2、 ,关闭 ,缓慢挤压气囊B,这样往复进行上述操作.当用玻璃棒蘸取溶液点在滤纸上,只有 色,说明反应完全.
(4)该实验设计的优点是 .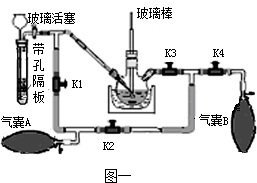
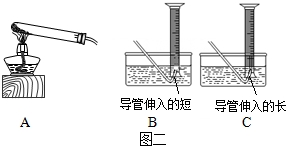
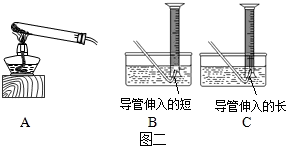
KMnO4含量测定:
(5)利用高锰酸钾加热分解测定样品中KMnO4的质量分数,应选择装置A和装置 组合(固定装置略),试管口塞有棉花团的作用是 .
(6)实验步骤:精确称量一定质量高锰酸钾样品;点燃酒精灯加热;当 时,收集气体; 酒精灯,冷却后调节量筒高度,并使量筒内外液面相平,读取气体体积.
(7)若量筒的规格是100mL,O2的密度为1.420g/L,则KMnO4样品最多称取 g(保留两位小数).
(8)若KMnO4样品质量为1g,测得O2体积为56.3mL.计算样品KMnO4的含量(O2的质量保留两位小数,写出计算过程,).
(9)若测定的KMnO4样品纯度偏大,其原因可能是 .
查看习题详情和答案>>
KMnO4的制取:
实验室制取KMnO4的方法和步骤是①高温灼烧MnO2、KOH等获得K2MnO4固体②用适量热蒸馏水溶解K2MnO4③加热K2MnO4溶液并缓慢通入CO2,反应生成KMnO4、K2CO3和MnO2④悬浊液经过滤,…,低温烘干,最终制得高锰酸钾晶体.
(1)步骤②中用热蒸馏水溶解的目的是
(2)带孔隔板上的块状固体是
(3)实验操作是先打开K3、K2,关闭K1、K4,稍打开玻璃活塞,缓慢 通入CO2,未反应的CO2被气囊A收集.一段时间后,关闭玻璃活塞,打开K1、K3、K4,关闭K2,缓慢挤压气囊A将CO2排到反应液中,未反应的CO2被气囊B收集,打开K1、K2、
(4)该实验设计的优点是


KMnO4含量测定:
(5)利用高锰酸钾加热分解测定样品中KMnO4的质量分数,应选择装置A和装置
(6)实验步骤:精确称量一定质量高锰酸钾样品;点燃酒精灯加热;当
(7)若量筒的规格是100mL,O2的密度为1.420g/L,则KMnO4样品最多称取
(8)若KMnO4样品质量为1g,测得O2体积为56.3mL.计算样品KMnO4的含量(O2的质量保留两位小数,写出计算过程,).
(9)若测定的KMnO4样品纯度偏大,其原因可能是
高锰酸钾可以杀灭细菌,是家庭必备的常用消毒药.已知:K2MnO4溶液为绿色溶液.
KMnO4的制取:
实验室制取KMnO4的方法和步骤是①高温灼烧MnO2、KOH等获得K2MnO4固体②用适量热蒸馏水溶解K2MnO4③加热K2MnO4溶液并缓慢通入CO2,反应生成KMnO4、K2CO3和MnO2④悬浊液经过滤,…,低温烘干,最终制得高锰酸钾晶体.
(1)步骤②中用热蒸馏水溶解的目的是________,步骤③中获取KMnO4的化学方程式是________.步骤④中高锰酸钾晶体只能低温烘干的原因是________.
(2)带孔隔板上的块状固体是________,从长颈漏斗中加入的溶液是________.
(3)实验操作是先打开K3、K2,关闭K1、K4,稍打开玻璃活塞,缓慢 通入CO2,未反应的CO2被气囊A收集.一段时间后,关闭玻璃活塞,打开K1、K3、K4,关闭K2,缓慢挤压气囊A将CO2排到反应液中,未反应的CO2被气囊B收集,打开K1、K2、________,关闭________,缓慢挤压气囊B,这样往复进行上述操作.当用玻璃棒蘸取溶液点在滤纸上,只有________色,说明反应完全.
(4)该实验设计的优点是________.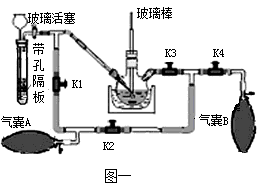
KMnO4含量测定:
(5)利用高锰酸钾加热分解测定样品中KMnO4的质量分数,应选择装置A和装置________组合(固定装置略),试管口塞有棉花团的作用是________.
(6)实验步骤:精确称量一定质量高锰酸钾样品;点燃酒精灯加热;当________时,收集气体;________酒精灯,冷却后调节量筒高度,并使量筒内外液面相平,读取气体体积.
(7)若量筒的规格是100mL,O2的密度为1.420g/L,则KMnO4样品最多称取________g(保留两位小数).
(8)若KMnO4样品质量为1g,测得O2体积为56.3mL.计算样品KMnO4的含量(O2的质量保留两位小数,写出计算过程,).
(9)若测定的KMnO4样品纯度偏大,其原因可能是________.
查看习题详情和答案>>
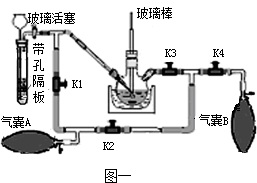
高锰酸钾可以杀灭细菌,是家庭必备的常用消毒药.已知:K2MnO4溶液为绿色溶液.
KMnO4的制取:
实验室制取KMnO4的方法和步骤是①高温灼烧MnO2、KOH等获得K2MnO4固体②用适量热蒸馏水溶解K2MnO4③加热K2MnO4溶液并缓慢通入CO2,反应生成KMnO4、K2CO3和MnO2④悬浊液经过滤,…,低温烘干,最终制得高锰酸钾晶体.
(1)步骤②中用热蒸馏水溶解的目的是______,步骤③中获取KMnO4的化学方程式是______.步骤④中高锰酸钾晶体只能低温烘干的原因是______.
(2)带孔隔板上的块状固体是______,从长颈漏斗中加入的溶液是______.
(3)实验操作是先打开K3、K2,关闭K1、K4,稍打开玻璃活塞,缓慢 通入CO2,未反应的CO2被气囊A收集.一段时间后,关闭玻璃活塞,打开K1、K3、K4,关闭K2,缓慢挤压气囊A将CO2排到反应液中,未反应的CO2被气囊B收集,打开K1、K2、______,关闭______,缓慢挤压气囊B,这样往复进行上述操作.当用玻璃棒蘸取溶液点在滤纸上,只有______色,说明反应完全.
(4)该实验设计的优点是______.
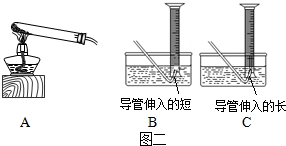
KMnO4含量测定:
(5)利用高锰酸钾加热分解测定样品中KMnO4的质量分数,应选择装置A和装置______组合(固定装置略),试管口塞有棉花团的作用是______.
(6)实验步骤:精确称量一定质量高锰酸钾样品;点燃酒精灯加热;当______时,收集气体;______酒精灯,冷却后调节量筒高度,并使量筒内外液面相平,读取气体体积.
(7)若量筒的规格是100mL,O2的密度为1.420g/L,则KMnO4样品最多称取______g(保留两位小数).
(8)若KMnO4样品质量为1g,测得O2体积为56.3mL.计算样品KMnO4的含量(O2的质量保留两位小数,写出计算过程,).
(9)若测定的KMnO4样品纯度偏大,其原因可能是______.
查看习题详情和答案>>
KMnO4的制取:
实验室制取KMnO4的方法和步骤是①高温灼烧MnO2、KOH等获得K2MnO4固体②用适量热蒸馏水溶解K2MnO4③加热K2MnO4溶液并缓慢通入CO2,反应生成KMnO4、K2CO3和MnO2④悬浊液经过滤,…,低温烘干,最终制得高锰酸钾晶体.
(1)步骤②中用热蒸馏水溶解的目的是______,步骤③中获取KMnO4的化学方程式是______.步骤④中高锰酸钾晶体只能低温烘干的原因是______.
(2)带孔隔板上的块状固体是______,从长颈漏斗中加入的溶液是______.
(3)实验操作是先打开K3、K2,关闭K1、K4,稍打开玻璃活塞,缓慢 通入CO2,未反应的CO2被气囊A收集.一段时间后,关闭玻璃活塞,打开K1、K3、K4,关闭K2,缓慢挤压气囊A将CO2排到反应液中,未反应的CO2被气囊B收集,打开K1、K2、______,关闭______,缓慢挤压气囊B,这样往复进行上述操作.当用玻璃棒蘸取溶液点在滤纸上,只有______色,说明反应完全.
(4)该实验设计的优点是______.


KMnO4含量测定:
(5)利用高锰酸钾加热分解测定样品中KMnO4的质量分数,应选择装置A和装置______组合(固定装置略),试管口塞有棉花团的作用是______.
(6)实验步骤:精确称量一定质量高锰酸钾样品;点燃酒精灯加热;当______时,收集气体;______酒精灯,冷却后调节量筒高度,并使量筒内外液面相平,读取气体体积.
(7)若量筒的规格是100mL,O2的密度为1.420g/L,则KMnO4样品最多称取______g(保留两位小数).
(8)若KMnO4样品质量为1g,测得O2体积为56.3mL.计算样品KMnO4的含量(O2的质量保留两位小数,写出计算过程,).
(9)若测定的KMnO4样品纯度偏大,其原因可能是______.