网址:http://m.1010jiajiao.com/timu_id_882591[举报]
实验探究让化学更具魅力,请帮助完成下列实验探究
(1)同学们在做完“二氧化碳的实验室制取”后,对废液进行了如下处理:过滤,取滤液于烧杯中,逐滴滴入Na2CO3溶液至过量.
记录滴入Na2CO3溶液质量(x)与有关的变化关系如图
所示.图中纵坐标(y)表示_______________,AB段
发生反应的化学方程式是___________________ _____,
_____,
反应进行到A点时,溶液中的溶质是______________,
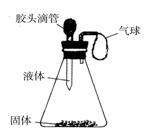 C点时溶液的 pH___ _(填“>”“<”“=”)7.
C点时溶液的 pH___ _(填“>”“<”“=”)7.
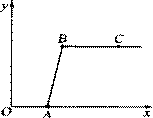 (2)如图所示,一同学挤压胶头滴管中的液体,
(2)如图所示,一同学挤压胶头滴管中的液体,
使之与瓶中固体接触,小气球鼓了起来。
请写出符合这一现象的化学方程式:
①置换反应_____________________ __;
__;
②化合反应_________________________。
(3)实验室中,同学们发现一瓶石灰水试剂瓶瓶壁和瓶塞周围有一些白色粉末.为了弄清楚白色粉末的成分及形成原因,他们进行了如下探究:
①对白色粉末成分的猜想和成因分析:
| 白色粉末的成分 | 形 |
| 可能是CaCO3 | 石灰水与空气中CO2反应: 化学方程式为: |
| 可能是 | 随着气温的升高,溶质的溶解度会 (填变大或变小)或溶剂蒸发,石灰水中的溶质析出 |
经过反复思考,同学们认为白色粉末还可能是以上两种物质的混合物.
②设计实验:甲同学取白色粉末装入试管中,加入少量的水、振荡,发现有白色固体不溶解,于是他得出粉末中只有CaCO3的结论。乙同学查阅了溶解性表,认为甲同学的结论不严密,理由是: 。
为了得出较严密的结论,他们进行了如下实验,请完成下列实验报告:
| 实 验 步 骤 | 可能观察到的现象 | 结 论 |
| 取上述试管中的上层清液,滴加1~2滴无色酚酞试液 | 溶液变红 |
|
| 往上述试管内残留的固体中加入 |
| 白色粉末中含有CaCO3 |
③交流与反思
通过上述实验的探究,同学们向实验室提出保存、使用易变质的溶液时的下列建议,合理的是 。A.密封保存 B.使用前,临时配制 (填序号)
查看习题详情和答案>>某校研究性学习小组到实验室进行探究实验。他们准备用加热高锰酸钾的方法取氧气并验证氧气的性质。
(1)写出用该方法制取氧气的化学反应文字表达式 。
(2)请指出图中所用仪器的名称:
a b c d
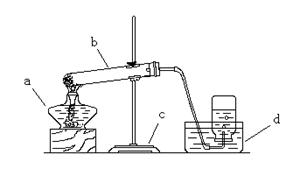 (3)他们所用的装置图中有一些错误, 请你为他们指出来:
(3)他们所用的装置图中有一些错误, 请你为他们指出来:
①.
②. 
③.
④.
(4)收集满氧气后,应用玻璃片盖住集气瓶口,并 (填“正放”或“倒放”)在桌上。
(5)他们用这种方法收集了两瓶气体。在先收集的一瓶插入带火星的木条,火星亮了一些,插入后收集的一瓶 木条则能复燃。导致这个现象的可能的原因是(写出操作上的原因): 。
木条则能复燃。导致这个现象的可能的原因是(写出操作上的原因): 。
(6)本实验中收集氧气用的是 法;又因为氧气的密度比空气 ,所以还可用__________法,此时可用___________检验气体已收集满了。
查看习题详情和答案>>某校化学小组对热水壶底部水垢的主要成份进行了如下探究,请完成以下活动,并回答相关问题。
【查阅资料】天然水中含有Ca2+、Mg2+、HCO3-等离子,在加热条件下,这些离子趋于生成溶解度更小的物质----水垢(主要成份为碳酸盐和碱)。有关物质的溶解性见下表:
部分钙、镁化合物溶解性表(20℃)
| 阴离子 阳离子 | OH- | CO32- | HCO3- |
| Ca2+ | 微溶 | 不溶 | 可溶 |
| Mg2+ | 不溶 | 微溶 | 可溶 |
【提出猜想】
猜想一:水垢的成分是_______________
猜想二:水垢的成分是CaCO3、Mg(OH)2、Ca(0H)2
猜想三:水垢的成分是CaCO3、Mg(OH)2、MgCO3
猜想四:水垢的成分是CaC O3、Mg(OH)2、Ca(0H)2 MgCO3
O3、Mg(OH)2、Ca(0H)2 MgCO3
【方案设计】
(1)确定水垢中是否含有氢氧化钙(2)确定水垢中是否含有碳酸镁
【实验步骤】
(1)
| 实验步骤 | 实验现象 | 实验结论 |
| 在少量研碎的水垢中加入适量的蒸馏水充分搅拌,过滤,再滤液中加入_ | 有___________产生 | 水垢中有 氢氧化钙 |
(2)利用下图实验装置完成(2)的探究,其主要实验步骤如下:
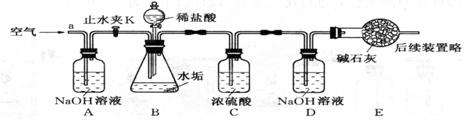
Ⅰ.称量D、E装置总质量为400.00g
Ⅱ.按上图组装后,将3g水垢样品放入锥形瓶中,加入足量稀盐酸至锥形瓶中不再产生气泡,关闭分液漏斗活塞
Ⅲ.打开止水夹K,从导管a处缓缓鼓入空气,一段时间后称量装置D、E的总质量为401.54g(碱石灰主要成份为CaO和NaOH,不考虑装置内空气对实验的影响)。
根据实验回答下列问题:
①加入样品前还应___________________,装置C的作用是__________,反应结束后打开止水夹K,缓缓鼓入空气的目的是______________________________ ___________
___________
②装置D中的化学方程式为_____________________________
③装置B中生成CO2的质量为_________g,水垢中______含MgCO3 。
A.一定 B.一定不 C.可能 D.无法确定
【反思延伸】
如何证明水垢中确实有氢氧化镁,小华提出了自己的想法:
另取质量为3g的水垢,加入3.65%的稀盐酸与之反应,测得消耗稀盐酸Wg,结合以上实验结论,判断W的值满足_____________条件时,水垢中一定含有Mg(OH)2。
查看习题详情和答案>>
(填序号)。选择这些仪器的依据是 (填字母)。
A、属于固体与固体加热的反应 B、属于固体与液体不加热的反应 C、制取的气体难溶于水 D、制取的气体密度比空气大
(2)实验室制取CO2的发生装置可选用③④和⑧组装,仪器④的名称为 。若要得到干燥的CO2,制出的气体还需要经过一个干燥装置。下列装置(含试剂)中适合干燥CO2的装置为 (填装置下字母),气体流向为从 (填接口字母)流入。


另一部分同学(下称②组同学)分析认为,加氢氧化钠溶液的塑料瓶中发生了另一个反应,该反应的化学方程式为 。为证明本组观点正确,②组同学设计了以下实验方案:取B中溶液少量,滴入无色酚酞溶液,若溶液变为无色,说明CO2与氢氧化钠发生了反应,若仍为红色,说明CO2未与氢氧化钠反应。你认为②组同学的实验方案正确吗? (填“正确”或“不正确”),原因
。


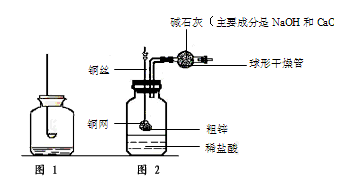

②小钱同学认为实验过程中缺少一个重要步骤,这个步骤是_____________________ 。
③实验时______(选填“可以”或“不可以”)用硫酸代替盐酸,原因是___________ 。
(2)他们还制作了一套如图2的装置,并用该装置测定粗锌样品的含锌量。
①称量10.0g粗锌放在铜网中,按图将仪器组装好以后,称得仪器和药品总质量为120.0g。
②将铜网插人足量稀盐酸中,充分反应,可以观察到的实验现象为____________________,反应的化学方程式______________________________。
③反应完全后,称得装置总质量为119.8g。则粗锌的纯度为___________。
④该实验中碱石灰的作用是___________________ 。若不用碱石灰,则所测定的粗锌纯度______(填“偏大”、“偏小”或“无影响” 。不考虑空气中CO2和H2O对实验的影响)。
⑤若将粗锌换成石灰石,原实验方案_________(填“能”或“不能”)用于石灰石样品纯度的测定,理由是__________________________。
 ________溶液
________溶液