摘要:先 再
网址:http://m.1010jiajiao.com/timu_id_882122[举报]
先取甲、乙、丙、丁四种金属粉末,分别投入相同浓度的稀盐酸中,只有甲、乙能产生气体,乙反应更剧烈;再取一小块丁投入丙的硝酸盐溶液中,丁的表面有丙析出.则甲、乙、丙、丁四种金属的活动性由强到弱顺序为( )
查看习题详情和答案>>
先写出下列反应的文字表达式,再回答问题
(1)镁条燃烧
(2)加热滴有石蕊的碳酸溶液
(3)二氧化碳通入澄清的石灰水
查看习题详情和答案>>
(1)镁条燃烧
镁+氧气
氧化镁
| 点燃 |
镁+氧气
氧化镁
,利用镁条燃烧能| 点燃 |
发出耀眼的白光
发出耀眼的白光
的性质,镁被用来制造照明弹;(2)加热滴有石蕊的碳酸溶液
碳酸
二氧化碳+水
| 加热 |
碳酸
二氧化碳+水
,实验现象| 加热 |
溶液由红色变成紫色
溶液由红色变成紫色
;(3)二氧化碳通入澄清的石灰水
二氧化碳+氢氧化钙→碳酸钙+水
二氧化碳+氢氧化钙→碳酸钙+水
,这个反应常被用来检验二氧化碳
二氧化碳
气体.先阅读下列短文,再回答下列问题:
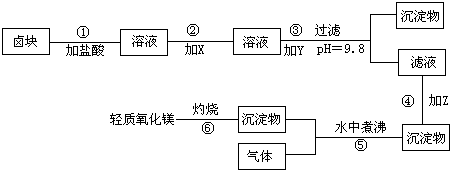
在酸性条件下,次氯酸钠(NaClO)、过氧化氢都有很强的氧化性,可将Fe2+氧化为Fe3+.Mg(OH)2和Fe(0H)3在溶液中生成时呈胶状物或絮状物沉淀,而MgCO3在水中煮沸可转变为Mg(OH)2.“卤块”的主要成分为MgCl2,还含有FeCl2、FeCl3、MnCl2等杂质.若以它为原料,按如图工艺流程即可制得“轻质氧化镁”.若要求产品不含杂质离子,而且成本较低,流程中所用试剂或pH控制可参考表1、表2来确定.
表1:
表2:
请填下列空白:
(1)写出盐酸溶液中NaClO将FeCl2氧化成FeCl3,同时生成NaCl和H2O的化学方程式:
(2)在步骤2中加入物质X,最佳的选择应是
(3)在步骤3中加入的物质应是
(4)在步骤4中加入物质应是
(5)在步骤5中发生的化学方程式为
查看习题详情和答案>>

在酸性条件下,次氯酸钠(NaClO)、过氧化氢都有很强的氧化性,可将Fe2+氧化为Fe3+.Mg(OH)2和Fe(0H)3在溶液中生成时呈胶状物或絮状物沉淀,而MgCO3在水中煮沸可转变为Mg(OH)2.“卤块”的主要成分为MgCl2,还含有FeCl2、FeCl3、MnCl2等杂质.若以它为原料,按如图工艺流程即可制得“轻质氧化镁”.若要求产品不含杂质离子,而且成本较低,流程中所用试剂或pH控制可参考表1、表2来确定.
表1:
| 物质 | 开始沉淀 | 沉淀完全 |
| Fe(OH)2 | 2.7 | 3.7 |
| Fe(OH)3 | 7.6 | 9.6 |
| Mn(OH)2 | 8.3 | 9.8 |
| Mg(OH)2 | 9.6 | 11.1 |
| 工业品 | 规格 | 价格(元/吨) |
| 漂液 | 含NaClO 25.5% | 450 |
| 过氧化氢 | 含H2O230% | 240 |
| 烧碱 | 含NaOH 98% | 2100 |
| 纯碱 | 含Na2CO3 99.5% | 600 |
| 卤块 | 含MgCl2 30% | 310 |
(1)写出盐酸溶液中NaClO将FeCl2氧化成FeCl3,同时生成NaCl和H2O的化学方程式:
NaClO+2FeCl2+2HCl═2FeCl3+NaCl+H2O
NaClO+2FeCl2+2HCl═2FeCl3+NaCl+H2O
,写出在盐酸溶液中H2O2将FeCl2氧化成FeCl3,同时生成H2O的化学方程式:H2O2+2HCl+2FeCl2═2FeCl3+2H2O
H2O2+2HCl+2FeCl2═2FeCl3+2H2O
.(2)在步骤2中加入物质X,最佳的选择应是
过氧化氢
过氧化氢
,理由是使用H2O2溶液成本低,且不含其他杂质离子
使用H2O2溶液成本低,且不含其他杂质离子
.(3)在步骤3中加入的物质应是
NaOH溶液
NaOH溶液
,之所以要控制pH=9.8,其目的是使FeCl3、MnCl2都转化为Fe(OH)3、Mn(OH)2沉淀,而大部分MgCl2尚未转化为Mg(OH)2,仍以MgCl2留在滤液中,达到分离杂质的目的
使FeCl3、MnCl2都转化为Fe(OH)3、Mn(OH)2沉淀,而大部分MgCl2尚未转化为Mg(OH)2,仍以MgCl2留在滤液中,达到分离杂质的目的
.(4)在步骤4中加入物质应是
碳酸钠
碳酸钠
.(5)在步骤5中发生的化学方程式为
MgCO3+H2O
Mg(OH)2+CO2↑
| ||
MgCO3+H2O
Mg(OH)2+CO2↑
.
| ||
先阅读下列资料,再回答有关问题.
过氧化氢(H2O2)的水溶液俗称双氧水.实验室可用以下两种方法制取氧气:
方法a:利用双氧水与二氧化锰混合:过氧化氢
水+氧气
方法b:将氯酸钾和二氧化锰混合加热:氯酸钾
氯化钾+氧气.
但是,若氯酸钾固体中混有可燃性杂质,加热时极可能发生爆炸;而且利用此法制得的氧气中往往含有一种有毒的杂质气体--氯气.
(1)现提供下列仪器装置:

(I)指出装置图中指定仪器名称:①
(II)选择方法b制氧气,气体的发生装置应选择
(III)某同学在关闭装置B中的弹簧夹后,向长颈漏斗中加入水时发现:当水浸没长颈漏斗下端后,长颈漏斗中的水就下不去了(如图F).这种现象说明该装置气密性
(2)请你从尽量多的角度分析,资料中制氧气的两种方法有哪些共同点?
共同点一:
共同点二:
(3)比较两种制氧气的方法,许多同学都认为较优的是方法a.你认为该方法具有哪些优点?
优点一:
优点二:
(4)也有同学认为方法a也有不足:利用方法a则应该选择装置B作气体的发生装置,而反应结束后,锥形瓶内还有大量的氧气没有能够收集,造成浪费.现提供烧杯、集气瓶和水,请你设计一个方案,收集锥形瓶中的氧气.你的操作方法是
查看习题详情和答案>>
过氧化氢(H2O2)的水溶液俗称双氧水.实验室可用以下两种方法制取氧气:
方法a:利用双氧水与二氧化锰混合:过氧化氢
| 二氧化锰 |
方法b:将氯酸钾和二氧化锰混合加热:氯酸钾
| 二氧化锰 |
| 加热 |
但是,若氯酸钾固体中混有可燃性杂质,加热时极可能发生爆炸;而且利用此法制得的氧气中往往含有一种有毒的杂质气体--氯气.
(1)现提供下列仪器装置:

(I)指出装置图中指定仪器名称:①
试管
试管
;②酒精灯
酒精灯
.(II)选择方法b制氧气,气体的发生装置应选择
A
A
,若利用氧气不易溶于水的性质,对应的收集装置应选择D
D
(填装置字母代号).不能用装置E来收集氧气的理由是氧气的密度比空气大
氧气的密度比空气大
.(III)某同学在关闭装置B中的弹簧夹后,向长颈漏斗中加入水时发现:当水浸没长颈漏斗下端后,长颈漏斗中的水就下不去了(如图F).这种现象说明该装置气密性
良好
良好
(填“良好”或“不好”).(2)请你从尽量多的角度分析,资料中制氧气的两种方法有哪些共同点?
共同点一:
都用二氧化锰作催化剂
都用二氧化锰作催化剂
;共同点二:
都有氧气生成;都属于分解反应等
都有氧气生成;都属于分解反应等
.(3)比较两种制氧气的方法,许多同学都认为较优的是方法a.你认为该方法具有哪些优点?
优点一:
不用加热;没有危险
不用加热;没有危险
;优点二:
没有污染;操作简单等
没有污染;操作简单等
.(4)也有同学认为方法a也有不足:利用方法a则应该选择装置B作气体的发生装置,而反应结束后,锥形瓶内还有大量的氧气没有能够收集,造成浪费.现提供烧杯、集气瓶和水,请你设计一个方案,收集锥形瓶中的氧气.你的操作方法是
从长颈漏斗向锥形瓶加满水,用集气瓶收集排出的气体
从长颈漏斗向锥形瓶加满水,用集气瓶收集排出的气体
.