摘要: 实验室废水随意排放会造成环境污染.某校实验室的废水中含有大量 AgNO3.Zn(NO3)2和Fe(NO3)2.该校实验小组设计实验从该废水中回收银.并得到副产品硫酸亚铁晶体.实验方案如下所示.(实验过程中未引入其他的金属元素)
网址:http://m.1010jiajiao.com/timu_id_881998[举报]
2012年“世界水日”的宣传主题是水与链式安全,水是生命之源,我们应该水,爱护水资源.某化学兴趣小组对某地水质状况进行了相关研究调查:
(1)取回水样,静置后过滤,在实验室里,过滤需要用到的玻璃仪器有 、漏斗和玻璃棒。
(2)若要测定某湖水质的酸碱性强弱,最适宜的是(填字母) 。
A. 酚酞试液 B. PH试纸 C.石蕊试液
(3)下列做法会造成水体污染的是 (填字母) .
A.随意弃置废旧电池 B.含二氧化硫的工业废气任意排放
C.工业废水处理达标后再排放 D.严格监管化肥和农药的使用
(4)节约用水从我做起请任举一生活中节约用水的措施:
(5)河水中含有许多杂质,可利用吸附、沉降、过滤、蒸馏等方法净化,其中净水程度最高的是 。生活中降低水硬度最常用的方法是 。
(6)在TiO2作催化剂和光照条件下,水能分解成氢气和氧气,写出该反应的化学方程式: 。
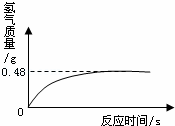
(7)过氧化氢溶液长期保存会自然分解,使得溶质质量分数减小。小军从家中拿来一瓶久置的医用过氧化氢溶液,和同学们一起测定溶质质量分数。他们取出该溶液51g,加入适量二氧化锰,生成气的质量与反应时间的关系如图所示。
试计算该过氧化氢溶液中溶质的质量分数。
2012年“世界水日”的宣传主题是水与链式安全,水是生命之源,我们应该水,爱护水资源.某化学兴趣小组对某地水质状况进行了相关研究调查:
(1)取回水样,静置后过滤,在实验室里,过滤需要用到的玻璃仪器有______、漏斗和玻璃棒.
(2)若要测定某湖水质的酸碱性强弱,最适宜的是(填字母)______.
A.酚酞试液 B.PH试纸 C.石蕊试液
(3)下列做法会造成水体污染的是 (填字母)______.
A.随意弃置废旧电池 B.含二氧化硫的工业废气任意排放
C.工业废水处理达标后再排放 D.严格监管化肥和农药的使用
(4)节约用水从我做起请任举一生活中节约用水的措施:______
(5)河水中含有许多杂质,可利用吸附、沉降、过滤、蒸馏等方法净化,其中净水程度最高的是______.生活中降低水硬度最常用的方法是______.
(6)在TiO2作催化剂和光照条件下,水能分解成氢气和氧气,写出该反应的化学方程式:______.
(7)过氧化氢溶液长期保存会自然分解,使得溶质质量分数减小.小军从家中拿来一瓶久置的医用过氧化氢溶液,和同学们一起测定溶质质量分数.他们取出该溶液51g,加入适量二氧化锰,生成气的质量与反应时间的关系如图所示.试计算该过氧化氢溶液中溶质的质量分数.
查看习题详情和答案>>
(1)取回水样,静置后过滤,在实验室里,过滤需要用到的玻璃仪器有______、漏斗和玻璃棒.
(2)若要测定某湖水质的酸碱性强弱,最适宜的是(填字母)______.
A.酚酞试液 B.PH试纸 C.石蕊试液
(3)下列做法会造成水体污染的是 (填字母)______.
A.随意弃置废旧电池 B.含二氧化硫的工业废气任意排放
C.工业废水处理达标后再排放 D.严格监管化肥和农药的使用
(4)节约用水从我做起请任举一生活中节约用水的措施:______
(5)河水中含有许多杂质,可利用吸附、沉降、过滤、蒸馏等方法净化,其中净水程度最高的是______.生活中降低水硬度最常用的方法是______.
(6)在TiO2作催化剂和光照条件下,水能分解成氢气和氧气,写出该反应的化学方程式:______.
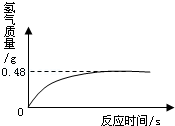
(7)过氧化氢溶液长期保存会自然分解,使得溶质质量分数减小.小军从家中拿来一瓶久置的医用过氧化氢溶液,和同学们一起测定溶质质量分数.他们取出该溶液51g,加入适量二氧化锰,生成气的质量与反应时间的关系如图所示.试计算该过氧化氢溶液中溶质的质量分数.

 2012年“世界水日”的宣传主题是水与链式安全,水是生命之源,我们应该水,爱护水资源.某化学兴趣小组对某地水质状况进行了相关研究调查:
2012年“世界水日”的宣传主题是水与链式安全,水是生命之源,我们应该水,爱护水资源.某化学兴趣小组对某地水质状况进行了相关研究调查:(1)取回水样,静置后过滤,在实验室里,过滤需要用到的玻璃仪器有
烧杯
烧杯
、漏斗和玻璃棒.(2)若要测定某湖水质的酸碱性强弱,最适宜的是(填字母)
B
B
.A.酚酞试液 B.PH试纸 C.石蕊试液
(3)下列做法会造成水体污染的是 (填字母)
AB
AB
.A.随意弃置废旧电池 B.含二氧化硫的工业废气任意排放
C.工业废水处理达标后再排放 D.严格监管化肥和农药的使用
(4)节约用水从我做起请任举一生活中节约用水的措施:
用洗菜水冲刷厕所
用洗菜水冲刷厕所
(5)河水中含有许多杂质,可利用吸附、沉降、过滤、蒸馏等方法净化,其中净水程度最高的是
蒸馏
蒸馏
.生活中降低水硬度最常用的方法是煮沸
煮沸
.(6)在TiO2作催化剂和光照条件下,水能分解成氢气和氧气,写出该反应的化学方程式:
2H20
2H2↑+O2↑
| ||
| 光照 |
2H20
2H2↑+O2↑
.
| ||
| 光照 |
(7)过氧化氢溶液长期保存会自然分解,使得溶质质量分数减小.小军从家中拿来一瓶久置的医用过氧化氢溶液,和同学们一起测定溶质质量分数.他们取出该溶液51g,加入适量二氧化锰,生成气的质量与反应时间的关系如图所示.试计算该过氧化氢溶液中溶质的质量分数.
 2012年“世界水日”的宣传主题是水与链式安全,水是生命之源,我们应该水,爱护水资源.某化学兴趣小组对某地水质状况进行了相关研究调查:
2012年“世界水日”的宣传主题是水与链式安全,水是生命之源,我们应该水,爱护水资源.某化学兴趣小组对某地水质状况进行了相关研究调查:
(1)取回水样,静置后过滤,在实验室里,过滤需要用到的玻璃仪器有______、漏斗和玻璃棒.
(2)若要测定某湖水质的酸碱性强弱,最适宜的是(填字母)______.
A.酚酞试液 B.PH试纸 C.石蕊试液
(3)下列做法会造成水体污染的是 (填字母)______.
A.随意弃置废旧电池 B.含二氧化硫的工业废气任意排放
C.工业废水处理达标后再排放 D.严格监管化肥和农药的使用
(4)节约用水从我做起请任举一生活中节约用水的措施:______
(5)河水中含有许多杂质,可利用吸附、沉降、过滤、蒸馏等方法净化,其中净水程度最高的是______.生活中降低水硬度最常用的方法是______.
(6)在TiO2作催化剂和光照条件下,水能分解成氢气和氧气,写出该反应的化学方程式:______.
(7)过氧化氢溶液长期保存会自然分解,使得溶质质量分数减小.小军从家中拿来一瓶久置的医用过氧化氢溶液,和同学们一起测定溶质质量分数.他们取出该溶液51g,加入适量二氧化锰,生成气的质量与反应时间的关系如图所示.试计算该过氧化氢溶液中溶质的质量分数.
查看习题详情和答案>>
绿矾(FeSO4?7H2O)、硫酸亚铁铵(FeSO4?(NH4)2SO4?6H2O)是重要的化学化工试剂.工业上常利用机械加工行业产生的废铁屑为原料制备.这种废铁屑中常混有FeS(其它杂质忽略不计),与稀硫酸反应为:FeS+H2SO4=FeSO4+H2S↑,H2S有毒,水溶液名称为氢硫酸.
请回答下列问题:
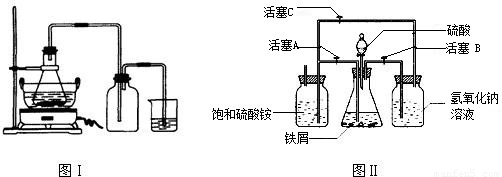
(1)图Ⅰ用于制备绿矾.锥形瓶中反应产生绿矾,其中盛放的药品或原料是______,发生的反应除前述化学方程式外,还一定有 (写化学方程式):______.
若知集气瓶的作用是作安全瓶,烧杯中发生的反应是:CuSO4+H2S=CuS↓+H2SO4,则烧杯中盛放的试剂是______,其作用为______.
(2)图Ⅱ用于制备硫酸亚铁铵(已知亚铁盐容易被氧化).在0~60℃的温度范围内,硫酸亚铁铵在水中的溶解度比硫酸铵、硫酸亚铁的溶解度小,所以硫酸亚铁与硫酸铵的混合溶液冷却至室温便析出硫酸亚铁铵.
具体操作:①打开活塞______,关闭活塞______,从______(填仪器名称)中滴下稀H2SO4到250mL规格的锥形瓶中,充分反应.②待锥形瓶中的铁屑快反应完时,关闭活塞______,打开活塞______.③放置一段时间,试剂瓶底部将结晶出硫酸亚铁铵.
实验中氢气的作用是______,
氢氧化钠溶液的作用是______.
(3)在制备硫酸亚铁的过程中,理论上控制铁过量或酸过量均有利于防止Fe2+被氧化.设计两个实验:实验一,控制酸过量;实验二,控制铁过量;其余步骤同,制得硫酸亚铁铵,并对产品质量进行检测.检测结果如下:
已知产品质量标准:Fe3+的质量分数等于0.005%,产品质量定为Ⅰ级;Fe3+的质量分数等于0.01%,产品质量定为Ⅱ级,从实验结果中,可得出制备硫酸亚铁溶液时,反应控制______过量为最佳.
(4)处理胶片的废液中含大量AgNO3、Zn(NO3)2和Fe(NO3)2,若随意排放不仅会造成严重的污染,而且造成资源浪费.某同学从上述的废液中回收金属银并得到副产品绿矾(FeSO4?7H2O),其回收流程如下:
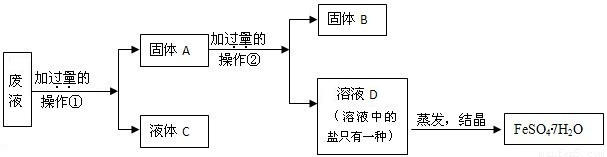
操作②是______,固体A中含______,固体B是______,
x是______,y是______,x、y过量的共同作用是______.
(5)硫酸最古老的生产方法是:把绿矾(FeSO4?7H2O)装入反应器中加强热,会流出油状液体,并放出有刺激性气味的气体(SO2),反应器中的固体变为红色.这个变化的过程可用两个化学方式表示.
①______ Fe2O3+SO2↑+SO3↑+14H2O 查看习题详情和答案>>

请回答下列问题:
(1)图Ⅰ用于制备绿矾.锥形瓶中反应产生绿矾,其中盛放的药品或原料是______,发生的反应除前述化学方程式外,还一定有 (写化学方程式):______.
若知集气瓶的作用是作安全瓶,烧杯中发生的反应是:CuSO4+H2S=CuS↓+H2SO4,则烧杯中盛放的试剂是______,其作用为______.
(2)图Ⅱ用于制备硫酸亚铁铵(已知亚铁盐容易被氧化).在0~60℃的温度范围内,硫酸亚铁铵在水中的溶解度比硫酸铵、硫酸亚铁的溶解度小,所以硫酸亚铁与硫酸铵的混合溶液冷却至室温便析出硫酸亚铁铵.
具体操作:①打开活塞______,关闭活塞______,从______(填仪器名称)中滴下稀H2SO4到250mL规格的锥形瓶中,充分反应.②待锥形瓶中的铁屑快反应完时,关闭活塞______,打开活塞______.③放置一段时间,试剂瓶底部将结晶出硫酸亚铁铵.
实验中氢气的作用是______,
氢氧化钠溶液的作用是______.
(3)在制备硫酸亚铁的过程中,理论上控制铁过量或酸过量均有利于防止Fe2+被氧化.设计两个实验:实验一,控制酸过量;实验二,控制铁过量;其余步骤同,制得硫酸亚铁铵,并对产品质量进行检测.检测结果如下:
| 序号 | 反应物用量(n表示微粒个数) | 产品质量 |
| 1 | n(H2SO4):n(Fe)>1:1 | 介于1级~Ⅱ级之间 |
| 2 | n(H2SO4):n(Fe)<1:1 | 优于1级 |
(4)处理胶片的废液中含大量AgNO3、Zn(NO3)2和Fe(NO3)2,若随意排放不仅会造成严重的污染,而且造成资源浪费.某同学从上述的废液中回收金属银并得到副产品绿矾(FeSO4?7H2O),其回收流程如下:

操作②是______,固体A中含______,固体B是______,
x是______,y是______,x、y过量的共同作用是______.
(5)硫酸最古老的生产方法是:把绿矾(FeSO4?7H2O)装入反应器中加强热,会流出油状液体,并放出有刺激性气味的气体(SO2),反应器中的固体变为红色.这个变化的过程可用两个化学方式表示.
①______ Fe2O3+SO2↑+SO3↑+14H2O 查看习题详情和答案>>