网址:http://m.1010jiajiao.com/timu_id_8574[举报]
一、(每小题1分,本题共34分)
1.C;2.B;3.A;4.D;5.D;6.B;7.A;8.C;9.D;10.A;11.C;12.B
13.A;14.B;15.D;16.C;17.B;18.C;19.B;20.C;21.D;22.D;23.C;24.A
25.C;26.B;27.A;28.C;29.A;30.C;31.D;32.D;33.C;34.C;;
二、(每小题2分,本题共6分)
35.B、D 36.B、D 37.C
三、(共38分)
38.四;11(每空0.5分,共1分)
39.O2;HCl;NaOH;C

(每空0.5分,共4分)
40.(1)B;A;C;D; (2)炸裂;从长颈漏斗口逸出;排净(每空0.5分,共3.5分)
41.可能是(1分)
42.(1)Fe+CuSO4 FeSO4+Cu;置换;
FeSO4+Cu;置换;
(2)2H2+O2 2H2O;化合;
2H2O;化合;
(3)CaCO3 CaO+CO2↑;分解;
CaO+CO2↑;分解;
(4)CuO+2HCl CuCl2+H2O;复分解(每个方程式1.5分,类型0.5分,共8分)
CuCl2+H2O;复分解(每个方程式1.5分,类型0.5分,共8分)
43.(1)18.0(0.5分);26.5%(1分) (2)冷却(0.5分)
44.B;A;C;紫色石蕊试液遇酸变红,遇碱变蓝。
(前面三空每空0.5分,最后一空1分,共25分)
45.①不能灭活泼金属的着火;②里;③镁是还原剂,发生氧化反应;④CO2是氧化剂,发生还原反应;⑤升高;⑥降低(每空0.5分,共3分)
46.(1)排列;(2)最外层电子数;(3)构成;(4)离子;(5)含碳量(或含铁量);
(6)含硫酸质量分数;(7)氯原子和氯离子:最外层电子数不同;(8)盐酸和稀硫酸:所含酸根离子不同。
(前面六空,每空0.5分,后面两空每空1分,共5分,其中(7)、(8)其它合理答案也给分)
47、(1)核外电子总数大于质子总数,为阴离子;
(2)核外电子排布相同而核电荷数不同,可分属于不同元素;
(3)原子失电子数等于其正价数;
(4)核外电子排布相同,但核电荷数不同,可分别是阳离子、阴离子、原子。
(每空1分,共4分,其它合理答案给分)
48.

(每空0.5分,共4分;其它合理答案也给分)
四、(共4分)
49.(1)减少建筑工地粉尘;(2)限制使用含铅汽油;(3)尽量用燃气代替燃煤;(4)工业废气经处理后才能排放。
(每空0.分,共2分,其它合理答案也给分)
50.①③;污水冲入长江后会造成二次污染(每空1分,共2分)
五、(共9分)
51.(1)灯火(0.5分);供氧设备(0.5分)
(2)①丙(0.5分)E接C(或D),D(或C)接A,B接F(1分,错一空不给分)②乙,蓝色(0.5分);甲,浑浊(0.5分);丁,黑色CuO变红(或澄清石灰水变浑浊);(0.5分)燃烧(0.5分)(本题共4.5分)
52.(1)供热 (2)①燃烧,产生白烟 ②右 (3)4,氧气约占空气体积的l/5。(每空0.5分,共2.5分)
53.A.Na2SO4;B.Na2CO3;C.Ba(OH)2;D.HCl。(每空0.5分,共2分)
六、(共9分)
54.解:(1)设需要赤铁矿石的质量为x。
Fe2O3+3CO 2Fe+3CO2 (0.5分)
2Fe+3CO2 (0.5分)
106 112
x×80%2 240吨×(1-4%)(0.5分)

x=3840吨 (0.5分)
答:需80%的赤铁矿石3840吨。 (0.5分)
(2)2320吨 (1分)
55.(1)20 (1分)
(2)解:设消耗19.6%稀硫酸溶液的质量为x,生成硫酸锌质量为y。
H2SO4+Zn ZnSO4+H2↑ (0.5分)
ZnSO4+H2↑ (0.5分)
98 65 161
x×19.6% 6.5克 y (0.5分)

x=50克(0.5分) y=16.1克 (0.5分)
烧杯中取用的稀硫酸含水的质量为
50克×(1-19.6%)=40.2克 (0.5分)
10℃时硫酸锌的溶解度为:

答:10℃时硫酸锌的溶解度为47.1克 (0.5分
(1)下列实验操作或对实验事实的叙述中存在错误的是__ ____(填序号)
A、用50 mL酸式滴定管准确量取25.00 mL 酸性KMnO4溶液,放入锥形瓶中待用
B、在测定硫酸铜晶体的结晶水时,将灼烧硫酸铜晶体的坩埚放在空气中冷却,然后称量
C、中和热的测定所需的玻璃仪器有烧杯、温度计、量筒
D、实验室中进行的下列实验需水浴加热:①乙酸乙酯的制备②葡萄糖的银镜反应
E、配制1 mol?L-1的NaOH溶液时,下列操作会造成所配浓度偏低:①溶解后烧杯未多次洗涤 ②定容时仰视刻度线 ③容量瓶中原有少许蒸馏水
F、实验室配制氯化亚铁溶液时,将氯化亚铁先溶解在盐酸中,然后用蒸馏水稀释并加入少量铁粉
G、容量瓶检漏:在容量瓶中注入适量的水,塞上玻璃瓶塞,左手五指托住瓶底,右手食指顶住瓶塞,反复倒置数次,观察是否漏水
H、不用其他试剂无法鉴别下列四种溶液:Na2CO3、Al2(SO4)3、NaCl、NaHSO4
I、可以用分液漏斗分离下列三组液态混合物:硝基苯和水、油酸和水、乙酸乙酯和乙醇
J、实验室保存少量液溴和白磷常用水封
(2)某研究性学习小组拟用明矾制取Al2(SO4)3晶体和K2SO4晶体。
①实验室除明矾外,已备好的用品有蒸馏水、氨水、pH试纸,还缺少的试剂有 。
②制得Al2(SO4)3与K2SO4物质的量之比小于 。
(3)“磨砂”是增加玻璃仪器密封性的一种处理工艺 ,可使仪器不漏液或不漏气。在下列仪器中:①试管;②分液漏斗;③细口试剂瓶;④广口试剂瓶;⑤集气瓶;⑥滴瓶;⑦酸式滴定管;⑧碱式滴定管,肯定用不到“磨砂” 处理的有 (填序号)。
(4)碱式氯化铜 (不溶于水的绿色结晶)是一种农药,化学式为:CuCl2·3Cu(OH)2·xH2 O。为验证其组成并确定X值,某学生设计了以下几步实验
①取a g碱式氯化铜的晶体制成粉末。
②将晶体加热至确认质量不再变化为止(铜仍为二价),冷却后称其质量为b g。
③另取a g碱式氯化铜的晶体,溶于足量硝酸中,得到溶液。
④向③得到的溶液中加入足量的硝酸银溶液,最后得到纯净固体,称量为c g。
若以上操作均正确,试回答下列问题:
A.将晶体制成粉末,所用的主要化学仪器是 (填仪器名称)。以上四步中,用到玻璃棒的步骤有 (填序号)
B.步骤②灼烧后得到的固体应为: 。
C.步骤④主要包括:加入足量硝酸银溶液→ → → 晾干→称量
查看习题详情和答案>>a.实验室里同学们要配制一定溶质质量分数的氯化钙溶液.药品柜中可供选择的药品只有氢氧化钙、氧化钙、碳酸钙和硝酸钙四种固体及一定溶质质量分数的稀盐酸.同学们交流讨论后,选择了一种固体药品并称取15g加入烧杯中,再向其中加入105.4g稀盐酸,充分反应后过得到5g固体和111 g氯化钙溶液(实验中物质损耗忽略不计),并将上述配好的氯化钙溶液倒入贴有相应标签的试剂瓶中.请回答下列问题:
(1)同学们选择的固体药品是
(2)请写出题中发生反应的化学方程式
(3)请根据已知条件求解生成氯化钙质量
b.现一块铜合金,可能是黄铜(铜锌合金)、青铜(铜、锡合金)、白铜[铜、镍(Ni)合金]中的一种,现欲测定其组成.
[查阅资料]Ⅰ.锌、锡、镍皆能与稀硫酸发生置换反应,生成+2价的金属离子;
Ⅱ.相对原子质量Zn-65,Sn-119,Ni-59.
[实验步骤及数据]取5g合金粉碎后放入烧杯中,将20g15%稀H2SO4分四次加入烧杯中充分反应后,测定剩余固体质量数据记录如下:
| 次数 | 1 | 2 | 3 | 4 |
| 加入酸的质量/g | 5.0 | 5.0 | 5.0 | 5.0 |
| 剩余固态质量/g | 4.5 | 4 | 3.5 | 3.2 |
(本题有a、b两小题,考生任选一题解答,不得两题都解.若两题都解,则以a小题计分)
a.实验室里同学们要配制一定溶质质量分数的氯化钙溶液.药品柜中可供选择的药品只有氢氧化钙、氧化钙、碳酸钙和硝酸钙四种固体及一定溶质质量分数的稀盐酸.同学们交流讨论后,选择了一种固体药品并称取15g加入烧杯中,再向其中加入105.4g稀盐酸,充分反应后过得到5g固体和111 g氯化钙溶液(实验中物质损耗忽略不计),并将上述配好的氯化钙溶液倒入贴有相应标签的试剂瓶中.请回答下列问题:
(1)同学们选择的固体药品是________;
(2)请写出题中发生反应的化学方程式________;
(3)请根据已知条件求解生成氯化钙质量________g.
b.现一块铜合金,可能是黄铜(铜锌合金)、青铜(铜、锡合金)、白铜[铜、镍(Ni)合金]中的一种,现欲测定其组成.
[查阅资料]Ⅰ.锌、锡、镍皆能与稀硫酸发生置换反应,生成+2价的金属离子;
Ⅱ.相对原子质量Zn-65,Sn-119,Ni-59.
[实验步骤及数据]取5g合金粉碎后放入烧杯中,将20g15%稀H2SO4分四次加入烧杯中充分反应后,测定剩余固体质量数据记录如下:
| 次数 | 1 | 2 | 3 | 4 |
| 加入酸的质量/g | 5.0 | 5.0 | 5.0 | 5.0 |
| 剩余固态质量/g | 4.5 | 4 | 3.5 | 3.2 |
a.实验室里同学们要配制一定溶质质量分数的氯化钙溶液.药品柜中可供选择的药品只有氢氧化钙、氧化钙、碳酸钙和硝酸钙四种固体及一定溶质质量分数的稀盐酸.同学们交流讨论后,选择了一种固体药品并称取15g加入烧杯中,再向其中加入105.4g稀盐酸,充分反应后过得到5g固体和111 g氯化钙溶液(实验中物质损耗忽略不计),并将上述配好的氯化钙溶液倒入贴有相应标签的试剂瓶中.请回答下列问题:
(1)同学们选择的固体药品是______;
(2)请写出题中发生反应的化学方程式______;
(3)请根据已知条件求解生成氯化钙质量______g.
b.现一块铜合金,可能是黄铜(铜锌合金)、青铜(铜、锡合金)、白铜[铜、镍(Ni)合金]中的一种,现欲测定其组成.
[查阅资料]Ⅰ.锌、锡、镍皆能与稀硫酸发生置换反应,生成+2价的金属离子;
Ⅱ.相对原子质量Zn-65,Sn-119,Ni-59.
[实验步骤及数据]取5g合金粉碎后放入烧杯中,将20g15%稀H2SO4分四次加入烧杯中充分反应后,测定剩余固体质量数据记录如下:
| 次数 | 1 | 2 | 3 | 4 |
| 加入酸的质量/g | 5.0 | 5.0 | 5.0 | 5.0 |
| 剩余固态质量/g | 4.5 | 4 | 3.5 | 3.2 |
查看习题详情和答案>>
(1)如图所示的仪器中配制溶液肯定不需要的是
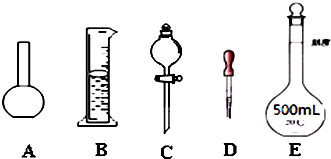
(2)下列操作中,容量瓶所不具备的功能有
A、配制一定体积准确浓度的标准溶液
B、贮存溶液
C、测量容量瓶规格以下的任意体积的液体
D、准确稀释某一浓度的溶液
E、用来加热溶解固体溶质
(3)根据计算用托盘天平称取NaOH的质量为
(4)根据计算得知,所需质量分数为98%、密度为1.84g/cm3的浓硫酸的体积为