网址:http://m.1010jiajiao.com/timu_id_84802[举报]
一、选择题
1.A 2.D 3.C 4.C 5.B 6.D 7.D 8.C 9.D 10.B
11.C 12.D 13.C
二、选择题
14.D 15.D 16.AC 17.CD 18.C 19.BC 20.B 21.D
三、非选择题
22.(18分)
(1)1.934~1.936;17.8(每空3分)
(2)①理科综合.files/image114.gif) (2分) ② 如图丙(5分) ③ 如图丁(5分)
(2分) ② 如图丙(5分) ③ 如图丁(5分)
理科综合.files/image188.jpg)
23.(1)由于系统无摩擦力,机械能守恒
最大弹性势能就是滑块开始的重力势能理科综合.files/image190.gif) (5分)
(5分)
(2)分离时,水平方向动量守恒 理科综合.files/image192.gif) ① (4分)
① (4分)
系统机械能守恒 理科综合.files/image194.gif) ② (4分)
② (4分)
由式①②得理科综合.files/image196.gif) (2分)
(2分)
24.(1)由于航天员处于完全失重状态,视重为零 (3分)
(2)轨道上有理科综合.files/image198.gif) (3分)
(3分)
得理科综合.files/image200.gif) 所以
所以理科综合.files/image202.gif) (2分)
(2分)
又有理科综合.files/image204.gif) (3分)
(3分)
得理科综合.files/image206.gif) 所以
所以理科综合.files/image208.gif) (2分)
(2分)
还有理科综合.files/image210.gif) (2分)
(2分)
理科综合.files/image212.gif) (2分)
(2分)
(3)应减速,使理科综合.files/image214.gif) ,让航天飞机靠近圆心 (2分)
,让航天飞机靠近圆心 (2分)
25.(1)由动能定理有理科综合.files/image216.gif) ① (3分)
① (3分)
理科综合.files/image218.gif)
(2)偏转场水平匀速理科综合.files/image220.gif) ② (1分)
② (1分)
竖直匀加速;理科综合.files/image222.gif) ③ (2分)
③ (2分)
理科综合.files/image224.gif) ④ (1分)
④ (1分)
理科综合.files/image226.gif) ⑤ (1分)
⑤ (1分)
由式①②③④代入式⑤有理科综合.files/image228.gif) ⑥ (2分)
⑥ (2分)
由式⑥得 理科综合.files/image230.gif) (1分)
(1分)
(3)带电微粒进入磁场做匀速圆周运动。
理科综合.files/image232.jpg)
由图可得 理科综合.files/image234.gif) ,所以
,所以理科综合.files/image236.gif) ⑦ (2分)
⑦ (2分)
进入磁场时的速度理科综合.files/image238.gif) ⑧ (2分)
⑧ (2分)
洛伦兹力提供向心力 理科综合.files/image240.gif) (2分)
(2分)
所以理科综合.files/image242.gif) (2分)
(2分)
26.(15分)
(1)S(2分)
(2)CH4<NH3<H2O(2分);共价键和离子键(2分); 离子晶体(2分);
(3)CO理科综合.files/image244.gif) +H2O
+H2O理科综合.files/image246.gif) HCO
HCO理科综合.files/image033.gif) +OH
+OH理科综合.files/image025.gif) 或C2O
或C2O理科综合.files/image250.gif) +H2O
+H2O理科综合.files/image246.gif) HC2O
HC2O理科综合.files/image252.gif) +OH
+OH理科综合.files/image025.gif) (3分)
(3分)
(4)0.3 mol Na2O2(2分);0.1 mol Na2CO3(2分)
27.(18分)
(1)防倒吸(2分)
(2)C、Cu、Na2SO3(3分)
(3)产生白色沉淀(2分);3NH3+3H2O+A1理科综合.files/image030.gif) ====Al(OH)3↓+3NH4(2分)
====Al(OH)3↓+3NH4(2分)
(4)产生淡黄色沉淀(2分); 2H2S+O2====2S↓+2H2O(2分)
(5)A:浓盐酸(1分);B:高锰酸钾(1分);
C:溴化钠(1分);Cl2+2Br理科综合.files/image025.gif) ====2Cl
====2Cl理科综合.files/image025.gif) +Br2(2分)
+Br2(2分)
28.(11分)
(1)乙和丙(2分)
(2)理科综合.files/image257.jpg) 或
或理科综合.files/image259.jpg) (2分)
(2分)
(3)2Na2O2+2H2O====4NaOH+O2↑(2分);0.6 mol(2分)
(4)OH理科综合.files/image025.gif) +CO2====HCO
+CO2====HCO理科综合.files/image033.gif) (3分)
(3分)
29.(16分)
(1)硝化反应(或取代反应)(1分);酯化反应(或取代反应)(1分)
(2)理科综合.files/image263.jpg) (2分);C:CH2OH(CHOH)4CHO(2分)
(2分);C:CH2OH(CHOH)4CHO(2分)
(3)理科综合.files/image264.jpg) 2C2H5OH+2CO2↑(3分);
2C2H5OH+2CO2↑(3分);
理科综合.files/image265.jpg) +H2O(3分)
+H2O(3分)
(4)理科综合.files/image267.jpg) (2分)
(2分)
30.(22分)
I.(8分)① 能(2分)② 能(2分),12
h光照下积累的有机物比12 h黑暗中消耗的有机物多(2分)③
Ⅱ.(14分)(每空2分)
(1)幼苗的细胞正在进行分裂,DNA在复制中容易发生基因突变
(2)基本不变
(3)子叶
(4)理科综合.files/image269.gif) ;单倍体育种
;单倍体育种
(5)脂肪;脂肪可以转化为可溶性糖,为种子萌发提供能量
31.I.(8分)(每空1分)
① a蛙的整个发育过程都在体外,需阳光使之保持适宜的温度,臭氧层的破坏使阳光中紫外线含量大增,易诱发变异,而变异对蛙的生存一般是不利的
b农田水体pH的变化会影响蛙的发育,从而降低蛙的成活率
② 大量使用农药 人类对蛙的过程捕杀
③ 不污染环境,保护生态平衡
a.引入害虫的寄生物
b.引入害虫的天敌(捕食者)
c.引入与害虫生存环境相似,但不危害农作物的竞争生物
d.运用转基因技术使农作物获得抗虫性状
e.运用昆虫激素的原理,诱杀害虫
f.以菌治虫等(任答三条即可)
Ⅱ.(12分)(每空1分)
(1)① 杂交;自交
② 选出F2中无芒抗病类型,连续自交,逐代去掉无芒不抗病类型,直到不发生性状分离
③ AaBb;有芒抗病;aaBB
(2)① 杂交;减数分裂
② 花药离体培养;秋水仙素处理幼苗; 2
(3)单倍体育种能明显的缩短育种年限
已知⑴H2(g)+ 1/2 O2(g)=H2O(g); △H1=a kJ/mol
⑵2H2(g)+ O2(g)=2H2O(g); △H2=b kJ/mol
⑶H2(g)+ 1/2O2(g)=H2O(l); △H3=c kJ/mol
⑷2H2(g)+ O2(g)=2H2O(l); △H4=d kJ/mol
下列关系式中正确的是( )
A.a<c<0 B.b>d>0 C.2a=b<0 D.2c=d>0
查看习题详情和答案>>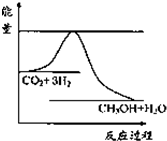 (1)一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ?mol-1)的变化.关于该反应的下列说法中,正确的是
(1)一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ?mol-1)的变化.关于该反应的下列说法中,正确的是A.△H>0,△S>0 B.△H>0,△S<0
C.△H<0,△S<0 D.△H<0,△S>0
(2)由氢气和氧气反应生成1mol水蒸气时,放出热量241.8kJ,写出该反应的热化学方程式
(3)写出乙醇在催化剂下催化氧化生成乙醛的化学方程式
(4)将两个石墨电极插人KOH溶液中,向两极分别通入H2和O2,构成氢气燃料电池.通入O2的一极,其电极反应式是:O2+4e-+2H2O=4OH-;通入H2的一极,其电极反应式是
(12分)(1)有科学家提出“绿色自由”的构想:将CO2变为燃料或有机化学品。其构想分成3个步骤:
① 利用浓碳酸钾溶液吸收空气中的CO2;
② 将第①步吸收液电解产生H2和O2,同时分离出CO2;
③ 将第②步产生的H2和CO2在一定条件下转化成CH4和水蒸气。
已知:H2(g)+0.5O2(g)=H2O(l) △H1= —285.8 kJ/mol
CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H2=—889.6 kJ/mol
H2O(l)=H2O(g) △H3=+44.0 kJ/mol
第③步反应的热化学方程式为 。
(2)使用合适的催化剂和电极材料,以N2、H2为原料,以HCl-NH4Cl为电解质溶液构成新型燃料电池,同时达到固氮作用。该电池的正极反应式为 ,溶液中H+向 极移动(选择填写“正”或“负”)。
(3)某催化剂的主要成分是FeO、Fe2O3,当催化剂中Fe2+与Fe3+的物质的量之比为1:2时,其催化活性最高。以Fe2O3为原料制备上述催化剂,可向其中加入适量炭粉,发生如下反应:
2Fe2O3+C4FeO+CO2。为制得这种活性最高的催化剂,应向480 g Fe2O3粉末中加入炭粉的质量为_____g。
(4)在T℃时,向2L固定体积的密闭容器中加入4mol A和2 mol B,发生如下反应:
2A(g) + B(g) C(g) + D(g) △H = Q kJ·mol-1
当反应达到平衡时,A的转化率为50﹪。
(ⅰ)在一定条件下,反应可以自发向右进行,可知Q __________0 (填“﹤”、“﹥”或“﹦”)。
(ⅱ)维持温度不变,若向该容器中加入的物质及量如下,使起始时v(正)>v(逆)且达到平衡时C的百分含量为20﹪。下列符合要求的是
A.2 mol A、1 molB B.1 mol He、3 mol A、1.5 mol B、0.5molC、0.5mol D
C.2 mol C、2 molD D.2 molA、1mol B、1 mol C、1 mol D
查看习题详情和答案>>
(12分)(1)有科学家提出“绿色自由”的构想:将CO2变为燃料或有机化学品。其构想分成3个步骤:
① 利用浓碳酸钾溶液吸收空气中的CO2;
② 将第①步吸收液电解产生H2和O2,同时分离出CO2;
③ 将第②步产生的H2和CO2在一定条件下转化成CH4和水蒸气。
已知:H2(g)+0.5O2(g)=H2O(l) △H1=" —285.8" kJ/mol
CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H2=" —889.6" kJ/mol
H2O(l)=H2O(g) △H3=" +44.0" kJ/mol
第③步反应的热化学方程式为 。
(2)使用合适的催化剂和电极材料,以N2、H2为原料,以HCl-NH4Cl为电解质溶液构成新型燃料电池,同时达到固氮作用。该电池的正极反应式为 ,溶液中H+向 极移动(选择填写“正”或“负”)。
(3)某催化剂的主要成分是FeO、Fe2O3,当催化剂中Fe2+与Fe3+的物质的量之比为1:2时,其催化活性最高。以Fe2O3为原料制备上述催化剂,可向其中加入适量炭粉,发生如下反应:
2Fe2O3+C 4FeO+CO2。为制得这种活性最高的催化剂,应向480 g Fe2O3粉末中加入炭粉的质量为_____g。
4FeO+CO2。为制得这种活性最高的催化剂,应向480 g Fe2O3粉末中加入炭粉的质量为_____g。
(4)在T℃时,向2L固定体积的密闭容器中加入4 mol A和2 mol B,发生如下反应:
2A(g) + B(g)  C(g) + D(g) △H =" Q" kJ·mol-1
C(g) + D(g) △H =" Q" kJ·mol-1
当反应达到平衡时,A的转化率为50﹪。
(ⅰ)在一定条件下,反应可以自发向右进行,可知Q __________0 (填“﹤”、“﹥”或“﹦”)。
(ⅱ)维持温度不变,若向该容器中加入的物质及量如下,使起始时v(正)>v(逆)且达到平衡时C的百分含量为20﹪。下列符合要求的是
A.2 mol A、1 mol B B.1 mol He、3 mol A、1.5 mol B、0.5molC、0.5mol D
C.2 mol C、2 mol D D.2 molA、1mol B、1 mol C、1 mol D
(12分)(1)有科学家提出“绿色自由”的构想:将CO2变为燃料或有机化学品。其构想分成3个步骤:
① 利用浓碳酸钾溶液吸收空气中的CO2;
② 将第①步吸收液电解产生H2和O2,同时分离出CO2;
③ 将第②步产生的H2和CO2在一定条件下转化成CH4和水蒸气。
已知:H2(g)+0.5O2(g)=H2O(l) △H1= —285.8 kJ/mol
CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H2= —889.6 kJ/mol
H2O(l)=H2O(g) △H3= +44.0 kJ/mol
第③步反应的热化学方程式为 。
(2)使用合适的催化剂和电极材料,以N2、H2为原料,以HCl-NH4Cl为电解质溶液构成新型燃料电池,同时达到固氮作用。该电池的正极反应式为 ,溶液中H+向 极移动(选择填写“正”或“负”)。
(3)某催化剂的主要成分是FeO、Fe2O3,当催化剂中Fe2+与Fe3+的物质的量之比为1:2时,其催化活性最高。以Fe2O3为原料制备上述催化剂,可向其中加入适量炭粉,发生如下反应:
2Fe2O3+C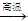 4FeO+CO2。为制得这种活性最高的催化剂,应向480 g Fe2O3粉末中加入炭粉的质量为_____g。
4FeO+CO2。为制得这种活性最高的催化剂,应向480 g Fe2O3粉末中加入炭粉的质量为_____g。
(4)在T℃时,向2L固定体积的密闭容器中加入4 mol A和2 mol B,发生如下反应:
2A(g) + B(g)  C(g) + D(g) △H = Q kJ·mol-1
C(g) + D(g) △H = Q kJ·mol-1
当反应达到平衡时,A的转化率为50﹪。
(ⅰ)在一定条件下,反应可以自发向右进行,可知Q __________0 (填“﹤”、“﹥”或“﹦”)。
(ⅱ)维持温度不变,若向该容器中加入的物质及量如下,使起始时v(正)>v(逆)且达到平衡时C的百分含量为20﹪。下列符合要求的是
A.2 mol A、1 mol B B.1 mol He、3 mol A、1.5 mol B、0.5molC、0.5mol D
C.2 mol C、2 mol D D.2 molA、1mol B、1 mol C、1 mol D
查看习题详情和答案>>