网址:http://m.1010jiajiao.com/timu_id_7728[举报]
 水合肼作为一种重要的精细化工原料,在农药、医药及有机合成中有广泛用途. 用尿素法制备水合肼,可分为两个阶段,第一阶段为低温氯化阶段,第二阶段为高温水解阶段,总反应方程式为:(NH2)2CO+NaClO+2NaOH→H2N-NH2?H2O+NaCl+Na2CO3.
水合肼作为一种重要的精细化工原料,在农药、医药及有机合成中有广泛用途. 用尿素法制备水合肼,可分为两个阶段,第一阶段为低温氯化阶段,第二阶段为高温水解阶段,总反应方程式为:(NH2)2CO+NaClO+2NaOH→H2N-NH2?H2O+NaCl+Na2CO3.主要副反应:N2H4+2NaClO=N2↑+2H2O+2NaCl△H<0,3NaClO=2NaCl+NaClO3△H>0,CO(NH2)2+2NaOH=2NH3↑+Na2CO3△H>0
【深度氧化】:(NH2)2CO+3NaClO=N2↑+3NaCl+CO2↑+2H2O△H<0
实验步骤:
步骤1.向30%的NaOH溶液中通入Cl2,保持温度在30℃以下,至溶液显浅黄绿色停止通Cl2.
步骤2.静置后取上层清液,检测NaCl0的浓度.
步骤3.倾出上层清液,配制所需浓度的NaClO和NaOH的混合溶液.
步骤4.称取一定质量尿素配成溶液,置于冰水浴.将一定体积步骤3配得的溶液倒入分液漏斗中,慢慢滴加到尿素溶液中,0.5h左右滴完后,继续搅拌0.5h.
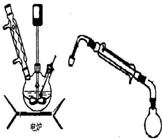
步骤5.将步骤4所得溶液,加入5g KMnO4作催化剂,转移到三口烧瓶(装置见图),边搅拌边急速升温,在108℃回流5min.
步骤6.将回流管换成冷凝管,蒸馏,收集( 108~114℃)馏分,得产品.
(1)步骤1温度需要在30℃以下,其主要目的是
(2)步骤2检测NaClO浓度的目的是
a.确定步骤3中需NaCl0溶液体积及NaOH质量
b.确定步骤4中冰水浴的温度范围
c.确定步骤4中称量尿素的质量及所取次氯酸钠溶液体积关系
d.确定步骤5所需的回流时间
(3)尿素法制备水合肼,第一阶段为反应
(4)步骤5必须急速升温,严格控制回流时间,其目的是
(5)已知水合肼在碱性条件下具有还原性(如:N2H4+2I2=N2+4HI).测定水合肼的质量分数可采用下列步骤:
a.准确称取2.000g试样,经溶解、转移、定容等步骤,配制250mL溶液.
b.移取10.00mL于锥形瓶中,加入20mL水,摇匀.
c.用0.1000mol/L碘溶液滴定至溶液出现微黄色且1 min内不消失,计录消耗碘的标准液的体积.
d.进一步操作与数据处理
①滴定时,碘的标准溶液盛放在
②若本次滴定消耗碘的标准溶液为18.00mL,可测算出产品中N2H4-H2O的质量分数为
③为获得更可靠的滴定结果,步骤d中进一步操作主要是:
水合肼作为一种重要的精细化工原料,在农药、医药及有机合成中有广泛用途。用尿素法制备水合肼,可分为两个阶段,第一阶段为低温氯化阶段,第二阶段为高温水解阶段,总反应方程式为:(NH2)2CO +NaClO+2NaOH → H2N—NH2·H2O+NaCl+Na2CO3。
主要副反应:N2H4+2NaClO= N2↑+2H2O+2NaCl △H<0
3NaClO=" 2NaCl" +NaClO3 △H>0
CO(NH2)2 +2NaOH= 2NH3↑+Na2CO3 △H>0
【深度氧化】:(NH2)2CO+3NaClO= N2↑+3NaCl+CO2↑+2H2O △H<0
实验步骤:
步骤1.向30%的NaOH溶液中通入Cl2,保持温度在30℃以下,至溶液显浅黄绿色停止通Cl2。
步骤2.静置后取上层清液,检测NaClO的浓度。
步骤3.倾出上层清液,配制所需浓度的NaClO和NaOH的混合溶液。
步骤4.称取一定质量尿素配成溶液,置于冰水浴。将一定体积步骤3配得的溶液倒入分液漏斗中,慢慢滴加到尿素溶液中,0.5h左右滴完后,继续搅拌0.5h。
步骤5.将步骤4所得溶液,加入5g KMnO4作催化剂,转移到三口烧瓶(装置见图),边搅拌边急速升温,在108℃回流5 min。

步骤6.将回流管换成冷凝管,蒸馏,收集( 108~114℃)馏分,得产品。
(1)步骤1温度需要在30℃以下,其主要目的是 。
(2)步骤2检测NaClO浓度的目的是 。
a.确定步骤3中需NaClO溶液体积及NaOH质量
b.确定步骤4中冰水浴的温度范围
c.确定步骤4中称量尿素的质量及所取次氯酸钠溶液体积关系
d.确定步骤5所需的回流时间
(3)尿素法制备水合肼,第一阶段为反应 (选填:“放热”或“吸热”)。
(4)步骤5必须急速升温,严格控制回流时间,其目的是 。
(5)已知水合肼在碱性条件下具有还原性(如:N2H4+2I2=N2+4HI)。测定水合肼的质量分数可采用下列步骤:
a.准确称取2.000g试样,经溶解、转移、定容等步骤,配制250mL溶液。
b.移取l0.00 mL于锥形瓶中,加入20mL水,摇匀.
c.用0.l000 mol/L碘溶液滴定至溶液出现微黄色且Imin内不消失,计录消耗碘的标准液的体积。
d.进一步操作与数据处理
①滴定时,碘的标准溶液盛放在 滴定管中(选填:“酸式”或“碱式”)。
②若本次滴定消耗碘的标准溶液为18.00mL,可测算出产品中N2H4-H2O的质量分数为 。
③为获得更可靠的滴定结果,步骤d中进一步操作主要是:
查看习题详情和答案>>

我国化工专家设计了联合制碱法,联合制碱法生产原理示意图如下:

请回答下列问题:
(1)从索尔维制碱法生产原理示意图可知,氨碱法的总反应方程式为
(2)试列举出索尔维制碱法的两大缺点.
①
②
(3)设计联合制碱法的我国化工专家是
(4)从联合制碱法生产原理示意图可知,原料Ⅲ中的CO2来自合成氨,指出步骤名称,并写产生CO2化学方程式.
步骤Ⅰ:
步骤Ⅱ:
族 周期 |
IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |
(2)金属单质与氢氧化钠能反应的是
(3)这些元素中的最高价氧化物对应的水化物中,酸性最强的物质是
(4)气态氢化物最稳定的化学式是
(5)写出⑤的氢氧化物与氢氧化钠溶液反应的离子方程式
(6)写出⑦通入⑩的钠盐溶液的化学方程式
(1)工业生产碘酸钾的流程如下:
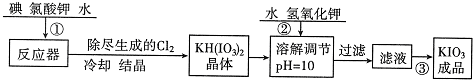
已知步骤①反应器中发生的反应为6I2+11KClO3+3H2O=6KH(IO3)2+5KCl+3Cl2↑.其中KH(IO3)2中I元素的化合价是
| 温度/℃ | 20 | 40 | 60 | 80 |
| KIO3/100gH2O | 8.08 | 12.6 | 18.3 | 24.8 |
(2)加碘食盐中碘元素的测定.
①已知:KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O;I2+2S2O32-=2I-+S4O62-
学生甲设计的实验步骤如下:
步骤1:准确称取w g食盐,加适量蒸馏水使其完全溶解;
步骤2:用稀硫酸酸化所得食盐溶液,加入过量KI溶液充分混合;
步骤3:以淀粉为指示剂,逐滴加入2.0×10-3 mol?L-1的Na2S2O310.0mL,恰好反应完全.则食盐样品中的碘元素含量是
| 1270 |
| 3w |
| 423.33 |
| w |
| 1270 |
| 3w |
| 423.33 |
| w |
②学生乙另取纯净的NaCl进行了下列实验:
| 实验步骤 | 实验操作 | 实验现象 |
| 步骤1 | 取1g纯净的NaCl,加3mL水配成溶液. | 溶液无变化 |
| 步骤2 | 滴入5滴淀粉溶液和1mL0.1 mol?L-1KI溶液,振荡. | 溶液无变化 |
| 步骤3 | 然后再滴入1滴1 mol?L-1的H2SO4,振荡. | 溶液变蓝色 |
③根据学生乙的实验结果,学生甲测得的食盐中碘元素的含量可能