网址:http://m.1010jiajiao.com/timu_id_62416[举报]
一、选择题(126分)
1.D 2.B 3.A 4.D 5.C 6.A 7.A 8.B 9.B 10.C 11.B 12.D 13.C
二、选择题
14.A 15.C 16.B 17.C 18.D 19.AD 20.A 21.BC
 三、非选择题(174分)
三、非选择题(174分)
22.I.AD(6分)
Ⅱ.(1)电路图(6分):
(2)
 (6分)
(6分)
23.解(1)设小球运动到管口的时间为t,则由运动学公式,对玻璃管有:
S1=at2………①…………(2分)
对小球,做自由落体运动,有:S2=gt2………②…………(2分)
由几何关系知:S1-S2=L………③…………(2分)
解①②③得t=0.5s…………(1分)
则小球到达管口时的速度v=gt=
(2)设小球从开始运动到再次回到玻璃管底部下落的高度为h,
由几何关系知:h=L……⑤…………(2分)
设此过程的时间为t',对小球:h=gt’2……⑥…………(2分)
解得①④⑤⑥得:t'=0.63s
24.解(1)P、Q被推开瞬间水平速度大小分别为vp、vQ
由动量守恒定律得:mpvp=mQvQ……①…………(3分)
由能量守恒得E=mpv+mQv=E……②…………(3分)
解①②得vp=
(2)P恰好到达A点时,只有重力提供向心力,设P在A点的速度为vA,
则:mpg=mp……③…………(3分)
对P从D被推开后到A,由动能定理得:
mpv+mpv=-μmpgS1-mpg∙2R…………④…………(4分)
由③④得:S1=
所以:当0<S1≤
25.解析:(1)磁场向 方向运动,等效金属框向
方向运动,等效金属框向 方向运动。
方向运动。
t=0时刻,金属框产生的电动势 (2分)
(2分)
 (2分)
(2分)
电流的方向根据右手定则可知为 (2分)
(2分)
(2)设经过时间t,金属框MN所在处磁场强度为B,
又 ,得到电流瞬时值的表达式是:
,得到电流瞬时值的表达式是: ,是正弦式电流。(5分)
,是正弦式电流。(5分)
(3)  (5分)
(5分)
(4)金属框受安培力的方向始终向左。设经过时间t,金属框受到安培力为
 由此可知:金属框受到安培力F随时间变化的图象如下图: (6分)
由此可知:金属框受到安培力F随时间变化的图象如下图: (6分)
26.(14分)
(1)①H2SO4 (2分)②S(s)+O2(g) = SO2(g); 297
297 (2分)
(2分)
③A (2分)
(2)①C+2H2SO4(浓)=CO2↑+2SO2↑+2H2O(2分)
②SO2+2CO = S+2CO2(2分)
③1.79t (4分)
27.(15分)(1)SO2 (2分) 4NH3+5O2  4NO+6H2O (2分)
4NO+6H2O (2分)
(2)第3周期第IIIA族(2分) 先产生白色沉淀,然后沉淀完全溶解(2分)
(3) +
+ =
=  + H2O(2分)n(NaHCO3):n(Na2CO3)=10┱1(3分)
+ H2O(2分)n(NaHCO3):n(Na2CO3)=10┱1(3分)
(4)④(2分)
28.(18分)(1)f、e、h、i、j、k、c(或d)、d(或c)、a(3分)
(2)吸收O2中的水蒸气(2分) 氧化没有燃烧完全的CO(2分)
2H2O2
 2H2O+O2↑
2H2O+O2↑
(3)1┱2┱2(2分)
(4)6CO(NH2) C3H6N6
+6NH3↑+3CO2↑(2分)
C3H6N6
+6NH3↑+3CO2↑(2分)
(5)尾部缺少一个干燥装置(2分)。空气中的水蒸气和CO2进入A装置,影响CO2的测定值(2分)。
29.(13分)(1)醛基(1分)
(2)①消去反应(1分)② (2分)
(2分)
③ (2分)、
(2分)、 (2分)
(2分)
④
 (2分)
(2分)
 +CH3COOH
+CH3COOH

 +H2O(3分)
+H2O(3分)
30.I.(14分)(1)等于(2分)(2)①适当升高温度(2分) 在一定的温度范围内,随着温度的升高,酶的活性增强,光合作用增强(2分) ②适当增大CO2的浓度(2分) 在一定的CO2浓度范围内,随着CO2浓度的增大,暗反应增强,光合作用增强(2分)(注:答案 ①与②的前后顺序可调换) (3)少(2分) 多(2分)
Ⅱ.(12分,每空2分)
(1)①实验动物数量太少(答案合理即可)
②A、B应放在相同的容器中培养
(2)①环境条件所允许的最大值(或K值或环境最大容纳量)
②S
③繁殖速度比B快(答案合理即可) 少
31.(16分)(1)基因突变 AA、Aa、aa
(2)①传粉前 花药
②单倍体幼苗 染色体加倍 AA或aa
③籽粒成熟(结种子、结果实)
(共5分)不对称催化合成反应研究是当今有机化学研究中最热门的前沿研究领域,这类反应的特点是使用少量的手性化合物为催化剂,把非手性的有机化合物转化为具有光学活性的手性化合物。三位有机化学家因在此研究领域内的卓越贡献而获得诺贝尔化学奖。下面是不对称催化合成反应的一个例子:

三甲基硅腈在手性镧配合物的催化下,与苯甲醛发生亲核加成反应,产物水解之后得到手性化合物A及少量的其对映异构体,请回答以下问题:
(1) 如若此亲核加成反应的决速步骤是氰基负离子(CN-)对醛基的加成,试推测:当对硝基苯甲醛在同样条件下进行此反应时,反应速率比苯甲醛快还是慢?为什么?
(2) 化合物A在盐酸水溶液中回流,转化为酸性化合物B,其分子式为C8H8O3,请画出化合物B的结构式,已知A结构式是S构型,请用系统命名法命名B。
查看习题详情和答案>>(14分)已知氨可以与灼热的氧化铜反应得到氮气和金属铜,反应方程式为2NH3+3CuO  N2+3H2O+3Cu,用示意图中的装置可以实现该反应,A中加的是氯化铵和氢氧化钙固体,C中的固体是氧化铜。回答下列问题:
N2+3H2O+3Cu,用示意图中的装置可以实现该反应,A中加的是氯化铵和氢氧化钙固体,C中的固体是氧化铜。回答下列问题:

(1)A中发生反应的化学方程式是 。
检验氨气通常采用的方法是________ _,其现象是__ ________。
(2)B中加入的物质是 ,其作用是 。
(3)实验时C中观察到的现象是 ,该反应中氨的作用是_______(填氧化剂或还原剂)。
(4)实验时在D中收集到的液态物质是 ,E中收集到的气体是__________。
(5)若要检验反应生成的水,可将试管D及烧杯部分改成两个相连的干燥管,(一种类似于U型管作用,内装固体干燥剂的管子)第一个干燥管X内装有______,现象是_______;第二个干燥管Y内装有碱石灰,作用是_____________。
查看习题详情和答案>>
(14分)已知氨可以与灼热的氧化铜反应得到氮气和金属铜,反应方程式为2NH3+3CuO N2+3H2O+3Cu,用示意图中的装置可以实现该反应,A中加的是氯化铵和氢氧化钙固体,C中的固体是氧化铜。回答下列问题:
(1)A中发生反应的化学方程式是 。
检验氨气通常采用的方法是________ _,其现象是__ ________。
(2)B中加入的物质是 ,其作用是 。
(3)实验时C中观察到的现象是 ,该反应中氨的作用是_______(填氧化剂或还原剂)。
(4)实验时在D中收集到的液态物质是 ,E中收集到的气体是__________。
(5)若要检验反应生成的水,可将试管D及烧杯部分改成两个相连的干燥管,(一种类似于U型管作用,内装固体干燥剂的管子)第一个干燥管X内装有______,现象是_______;第二个干燥管Y内装有碱石灰,作用是_____________。
查看习题详情和答案>>
下表是几种弱电解质的电离平衡常数、难溶电解质的溶度积Ksp (25℃)。
| 电解质 | 平衡方程式 | 平衡常数K | Ksp |
| CH3COOH | CH3COOH | 1.76×10-5 | |
| H2CO3 | H2CO3 HCO | K1=4.31×10-7 K2=5.61×10-11 | |
| C6H5OH | C6H5OH | 1.1×10-10 | |
| H3PO4 | H3PO4 H2PO HPO | K1=7.52×10-3 K2=6.23×10-8 K3=2.20×10-13 | |
| H3BO3 | 5.7×10-10 | ||
| NH3·H2O | NH3·H2O | 1.76×10-5 | |
| H2O | Kw=1.0×10-14 | ||
| Mg(OH)2 | Mg(OH)2 | 5.6×10-12 |
回答下列问题:
I.(1)由上表分析,若①CH3COOH ②HCO![]() ③C6H5OH ④H2PO
③C6H5OH ④H2PO![]() 均可看作酸,则它们酸性由强到弱的顺序为 (须填编号);
均可看作酸,则它们酸性由强到弱的顺序为 (须填编号);
(2)写出C6H5OH与Na3PO4反应的离子方程式: ;
(3)25℃时,将等体积等浓度的醋酸和氨水混合,混合液中:c(CH3COO-)
c(NH4+);(填“>”、“=”或“<”)
(4)25℃时,向10mL 0.01mol/L苯酚溶液中滴加VmL 0.01mol/L氨水,混合溶液中粒子浓度关系正确的是 ;
A.若混合液pH>7,则V≥10
B.若混合液pH<7,则c(NH4+)>c(C6H5O-)>c(H+)>c(OH-)
C.V=10时,混合液中水的电离程度大于10mL 0.01mol/L苯酚溶液中水的电离程度
D.V=5时,2c(NH3·H2O)+ 2 c(NH4+)= c(C6H5O-)+ c(C6H5OH)
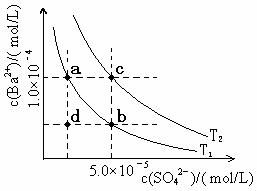 | |||
 | |||
(5)如左上图所示,有T1、T2两种温度下两条BaSO4在水中的沉淀溶解平衡曲线,回答下列问题:
① T1 T2(填>、=、<);
② 讨论T1温度时BaSO4的沉淀溶解平衡曲线,下列说法正确的是 。
A.加入Na2SO4可使溶液由a点变为b点
B.在T1曲线上方区域(不含曲线)任意一点时,均有BaSO4沉淀生成
C.蒸发溶剂可能使溶液由d点变为曲线上a、b之间的某一点(不含a、b)
D.升温可使溶液由b点变为d点
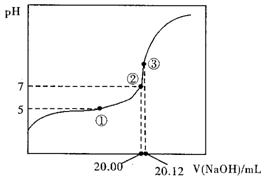
II.平衡常数的计算:
(1)用0.1000mol·L-1NaOH溶液滴定20.00mL某未知浓度的醋酸溶液,滴定曲线右上图。其中①点所示溶液中c(CH3COO-)=2c(CH3COOH)
③点所示溶液中存在:c(CH3COO-)+c(CH3COOH)=c(Na+)
则CH3COOH的电离平衡常数Ka= 。
(2)水解反应是典型的可逆反应。水解反应的化学平衡常数称为水解常数(用Kh表示),类比化学平衡常数的定义,请写出Na2CO3第一步水解反应的水解常数的表达式:Kh= 。
(3)MgCl2溶液和氨水混合后存在下列化学平衡:Mg2+(aq)+2NH3·H2O(aq)![]() 2NH4+(aq)+Mg(OH)2(s)
2NH4+(aq)+Mg(OH)2(s)
试列出该反应平衡常数K与Kb(NH3·H2O)、Ksp[Mg(OH)2]的关系式并计算: 。
查看习题详情和答案>>(15分)根据下图转化回答有关问题:
(1)① 写出AC反应生成乙酸乙酯的化学方程式_______________;
反应类型_______________;
② B的结构简式为_______________。
(2)某同学在实验室用如图所示的装置来制取乙酸乙酯。请回答下列问题:
① 浓硫酸的作用是_______________ _______________。
② 饱和碳酸钠溶液的主要作用_______________。
③ 装置中通蒸气的导管只能插到饱和碳酸钠溶液的液面处,不能插入溶液中,目的_______________ ,长导管的作用是_______________。
④ 若要把制得的乙酸乙酯分离出来,应采用的实验操作是_______________。
⑤ 进行该实验时,最好向试管甲中加入几块碎瓷片,其目的是_______________。
⑥ 生成乙酸乙酯的反应是可逆反应,反应物不能完全转化为生成物,反应一段时间后,就达到了该反应的限度,即达到化学平衡状态。下列描述不能说明该反应已达到化学平衡状态的是(填序号) _______________ 。
A.单位时间里,生成1mol乙酸乙酯,同时生成1mol水
B.单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸
C.单位时间里,消耗1mol乙醇,同时消耗1mol乙酸
D.正反应的速率与逆反应的速率相等
E.混合物中各物质的浓度不再变化
查看习题详情和答案>>