摘要::=5:4 根据几种解法在解题思路上差异.你倾向于使用哪一种解法 .
网址:http://m.1010jiajiao.com/timu_id_60605[举报]
一、选择题(共10分)
1.D 2.B 3.A 4.D 5.C
二、选择题(共45分)
6.A 7.C 8.C 9.D 10.D 11.A 12.B 13.A
14.C 15.A 16.D 17.B 18.A 19.C 20.D
三、填空题(38分)
21.(2分)方案3 22.(2分)解法3
23.(6分)(1)C、Fe F、H2
 (2)2 Fe2O3+
(2)2 Fe2O3+ 2SO3(g)△H=-2Q1 KJ/mol或SO2(g)+
2SO3(g)△H=-2Q1 KJ/mol或SO2(g)+

 +H+的电离平衡常数K=____________。(已知:10-5.6=2.5×10-6)。
+H+的电离平衡常数K=____________。(已知:10-5.6=2.5×10-6)。
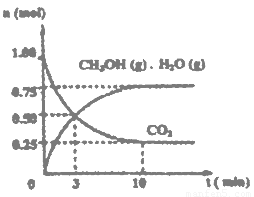

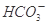 +H+的电离平衡常数 K=____________。(已知:10-5.6=2.5×10-6)。
+H+的电离平衡常数 K=____________。(已知:10-5.6=2.5×10-6)。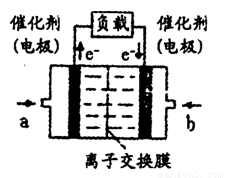


 +H+的电离平衡常数K=____________。(已知:10-5.6=2.5×10-6)。
+H+的电离平衡常数K=____________。(已知:10-5.6=2.5×10-6)。
 和
和 代表两种不同的粒子。E与D形成的化合物的晶胞是下列中的 (填序号),在该晶胞中阳离子的配位数为 。
代表两种不同的粒子。E与D形成的化合物的晶胞是下列中的 (填序号),在该晶胞中阳离子的配位数为 。