网址:http://m.1010jiajiao.com/timu_id_58294[举报]
(10分)氯化亚铜(CuCl)是白色粉末,不溶于水、乙醇,熔点422℃,沸点1366℃,在空气中迅速被氧化成绿色,常用作有机合成工业中的催化剂。以粗食盐水(含Ca2+、Mg2+、SO2-4等杂质)。Cu、稀硫酸,SO2等为原料合成CuCl的工艺如下: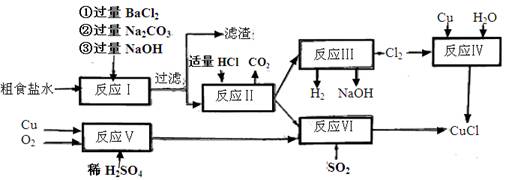
(1)反应I中加Na2CO3溶液的作用是 。
(2)反应II在电解条件下进行,电解时阳极发生的电极反应可表示为 。
(3)①写出反应V的化学方程式
②写出反应VI的离子反应方程式 。
(4)在整个合成过程中可以循环利用的物质是
(5)反应IV加入的Cu必须过量,其目的是 。
(6)反应VI后,过滤得到CuCl沉淀,用无水乙醇洗涤沉淀,在真空干燥机内于70℃干燥2小时,冷却,密封包装即得产品。于70℃真空干燥的目的是  。
。
(10分)氯化亚铜(CuCl)是白色粉末,不溶于水、乙醇,熔点422℃,沸点1366℃,在空气中迅速被氧化成绿色,常用作有机合成工业中的催化剂。以粗食盐水(含Ca2+、Mg2+、SO2-4等杂质)。Cu、稀硫酸,SO2等为原料合成CuCl的工艺如下:

(1)反应I中加Na2CO3溶液的作用是 。
(2)反应II在电解条件下进行,电解时阳极发生的电极反应可表示为 。
(3)①写出反应V的化学方程式
②写出反应VI的离子反应方程式 。
(4)在整个合成过程中可以循环利用的物质是
(5)反应IV加入的Cu必须过量,其目的是 。
(6)反应VI后,过滤得到CuCl沉淀,用无水乙醇洗涤沉淀,在真空干燥机内于70℃干燥2小时,冷却,密封包装即得产品。于70℃真空干燥的目的是 。
查看习题详情和答案>>
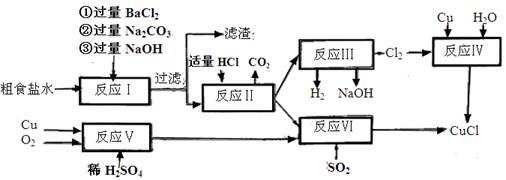
(1)反应I中加Na2CO3溶液的作用是 。
(2)反应II在电解条件下进行,电解时阳极发生的电极反应可表示为 。
(3)①写出反应V的化学方程式
②写出反应VI的离子反应方程式 。
(4)在整个合成过程中可以循环利用的物质是
(5)反应IV加入的Cu必须过量,其目的是 。
(6)反应VI后,过滤得到CuCl沉淀,用无水乙醇洗涤沉淀,在真空干燥机内于70℃干燥2小时,冷却,密封包装即得产品。于70℃真空干燥的目的是
 。
。Fe2+
| ① |
| ④ |
| ② |
| ③ |
回答下列有关问题:
(1)Fe与过量稀硫酸反应可以制取FeSO4.若用反应所得的酸性溶液,实现上述①的转化,要求产物纯净.可选用的试剂是
a.Cl2 b.Fe c.HNO3 d.H2O2
(2)上述转化得到的硫酸铁可用于电化浸出黄铜矿精矿工艺.精矿在阳极浸出的反应比较复杂,其中有一主要反应:CuFeS2+4Fe3+=Cu2++5Fe2++2S.(CuFeS2中S为-2价)则下列说法正确的是
a.从物质分类的角度看,黄铜矿属于合金
b.反应中,所有铁元素均被还原
c.反应中,CuFeS2 既作氧化剂又作还原剂
d.当转移1mol电子时,46g CuFeS2参加反应
(3)下述反应中,若FeSO4和O2的系数比为2:1,试配平下列方程式:FeSO4+K2O2→K2FeO4+K2O+K2SO4+O2↑
(4)高铁酸钾(K2FeO4)是一种新型、高效的绿色水处理剂,在水中发生反应生成Fe(OH)3.高铁酸钾作为水处理剂发挥的作用是
 Fe3+
Fe3+ FeO42-(高铁酸根离子)
FeO42-(高铁酸根离子)