网址:http://m.1010jiajiao.com/timu_id_58190[举报]
(13分)某学生为测定未知浓度的硫酸溶液,实验如下:用I.00mL待测硫酸配制100mL稀H2S04溶液;以0.14mol/L的NaOH溶液滴定上述稀H2S04 25mL,滴定终止时消耗NaOH溶液15mL。
(1)该学生用标准o.14mol/L的NaOH溶液滴定硫酸的实验操作如下:
A、用酸式滴定管取稀H2S0425mL,注入锥形瓶中,加入指示剂;
B、用待测定的溶液润洗酸式滴定管;
C、用蒸馏水洗干净滴定管;
D、取下碱式滴定管用标准的NaOH溶液润洗后,将标准液注入碱式滴定管刻度“0”以上1~2cm处,再把碱式滴定管固定好,调节液面至刻度“0”或“0”刻度以下;
E、检查滴定管是否漏水;
F、另取锥形瓶,再重复操作一次;
G、把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度。
①滴定操作的正确顺序是 (用序号填写)
②该滴定操作中应选用的指示剂是 。
③在G操作中如何确定终点? 。
(2)碱式滴定管用蒸馏水润洗后,未用标准液润洗导致滴定结果 (填“偏小”“偏大”或“恰好合适”),原因是 。
(3)计算待测硫酸(稀释前的硫酸)溶液的物质的量浓度为 mol/L(结果保留两位小数点)。
【解析】考查中和滴定实验操作及误差分析。滴定管在使用前需要查漏,然后用蒸馏水洗涤,最后用标准液润洗。硫酸和氢氧化钠恰好反应时,溶液显中性,所以应选择酚酞作指示剂。当反应达到滴定终点时,溶液将变成红色。若碱式滴定管未用标准液润洗,则相当于稀释了氢氧化钠溶液,从而导致消耗氢氧化钠溶液的体积偏大,测定结果偏大。根据题意可知消耗氢氧化钠的物质的量是0.14mol/L×0.015L=0.0021mol,所以需要硫酸的物质的量是0.00105mol,因此硫酸的浓度是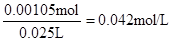 ,所以稀释前硫酸的浓度为0.042mol/L×100=4.2mol/L。
,所以稀释前硫酸的浓度为0.042mol/L×100=4.2mol/L。
查看习题详情和答案>>
(13分)某学生为测定未知浓度的硫酸溶液,实验如下:用I.00mL待测硫酸配制100mL稀H2S04溶液;以0.14mol/L的NaOH溶液滴定上述稀H2S04 25mL,滴定终止时消耗NaOH溶液15mL。
(1)该学生用标准o.14mol/L的NaOH溶液滴定硫酸的实验操作如下:
A、用酸式滴定管取稀H2S04 25mL,注入锥形瓶中,加入指示剂;
B、用待测定的溶液润洗酸式滴定管;
C、用蒸馏水洗干净滴定管;
D、取下碱式滴定管用标准的NaOH溶液润洗后,将标准液注入碱式滴定管刻度“0”以上1~2cm处,再把碱式滴定管固定好,调节液面至刻度“0”或“0”刻度以下;
E、检查滴定管是否漏水;
F、另取锥形瓶,再重复操作一次;
G、把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度。
①滴定操作的正确顺序是 (用序号填写)
②该滴定操作中应选用的指示剂是 。
③在G操作中如何确定终点? 。
(2)碱式滴定管用蒸馏水润洗后,未用标准液润洗导致滴定结果 (填“偏小”“偏大”或“恰好合适”),原因是 。
(3)计算待测硫酸(稀释前的硫酸)溶液的物质的量浓度为 mol/L(结果保留两位小数点)。
【解析】考查中和滴定实验操作及误差分析。滴定管在使用前需要查漏,然后用蒸馏水洗涤,最后用标准液润洗。硫酸和氢氧化钠恰好反应时,溶液显中性,所以应选择酚酞作指示剂。当反应达到滴定终点时,溶液将变成红色。若碱式滴定管未用标准液润洗,则相当于稀释了氢氧化钠溶液,从而导致消耗氢氧化钠溶液的体积偏大,测定结果偏大。根据题意可知消耗氢氧化钠的物质的量是0.14mol/L×0.015L=0.0021mol,所以需要硫酸的物质的量是0.00105mol,因此硫酸的浓度是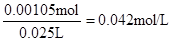 ,所以稀释前硫酸的浓度为0.042mol/L×100=4.2mol/L。
,所以稀释前硫酸的浓度为0.042mol/L×100=4.2mol/L。
查看习题详情和答案>>
(8分)现有以下四种溶液;①pH=2的CH3COOH溶液;②pH=2的HCl溶液;③pH=12的氨水;④pH=12的NaOH溶液.请回答下列问题:
(1) ②④溶液中由水电离出来的c(H+)的关系是:② ④(填“>”“<”或“=”).
(2) 将②③溶液等体积混合后,溶液的pH 7 (填“>”“<”或“:”). ,
(3)将①④溶液均稀释至原来的10倍后,它们的pH之和 14(填“>”“<”或“=”).
(4)向300 mL溶液④中通入44.8 mL C02(标准状况)气体,充分反应后,溶液中粒子浓度关系正确的是 ( )
A、c(Na+)+ c(H+)= c(OH—)+ c(HCO3—)+ 2c(CO32—)
B、 c(Na+)= c(HCO3—)+
c(CO32—)+ c(H2CO3)
c(Na+)= c(HCO3—)+
c(CO32—)+ c(H2CO3)
C、c(Na+)> c(CO32—)> c(HCO3—)> c(OH—)> c(H+)
D、c(Na+)> c(HCO3—)> c(CO32—)> c(OH—)> c(H+)
【解析】(1)水属于弱电解质,存在电离平衡:H2O H++OH—。所以不论是酸还是碱均是抑制水的电离,②和④中氢离子和OH—的的浓度均相同,抑制水的电离程度是相同的,所以由水电离出来的c(H+)是相同的。
H++OH—。所以不论是酸还是碱均是抑制水的电离,②和④中氢离子和OH—的的浓度均相同,抑制水的电离程度是相同的,所以由水电离出来的c(H+)是相同的。
(2)盐酸的浓度是0.01mol/L,氨水是弱电解质,所以其浓度大于0.01mol/L,因此反应后氨水是过量的,溶液显碱性,pH大于7.
(3)。强碱每稀释10n倍,强碱的pH就减小n个单位,所以pH=12的氢氧化钠稀释10倍,pH=11。但醋酸是弱电解质,稀释10倍后溶液的pH将大于3,所以它们的pH之和小于14.
(4)300mlpH=12的氢氧化钠,其物质的量是0.01mol/L×0.3L=0.003mol。44.8 mL C02(标准状况)气体的物质的量是0.002mol,所以二者混合反应后生成物是碳酸钠和碳酸氢钠的混合液,其中二者的物质的量均是0.001mol。CO32-的水解程度大于HCO3-的水解程度,所以选项C错误,D正确。选项A符合电荷守恒,选项B符合物料守恒,均正确。
查看习题详情和答案>>
(8分)现有以下四种溶液;①pH=2的CH3COOH溶液;②pH=2的HCl溶液;③pH=12的氨水;④pH=12的NaOH溶液.请回答下列问题:
(1) ②④溶液中由水电离出来的c(H+)的关系是:② ④(填“>”“<”或“=”).
(2) 将②③溶液等体积混合后,溶液的pH 7 (填“>”“<”或“:”). ,
(3)将①④溶液均稀释至原来的10倍后,它们的pH之和 14(填“>”“<”或“=”).
(4)向300 mL溶液④中通入44.8 mL C02(标准状况)气体,充分反应后,溶液中粒子浓度关系正确的是 ( )
A、c(Na+)+ c(H+)=c(OH—)+ c(HCO3—)+ 2c(CO32—)
B、![]() c(Na+)= c(HCO3—)+c(CO32—)+ c(H2CO3)
c(Na+)= c(HCO3—)+c(CO32—)+ c(H2CO3)
C、c(Na+)>c(CO32—)> c(HCO3—)> c(OH—)>c(H+)
D、c(Na+)>c(HCO3—)> c(CO32—)> c(OH—)>c(H+)
【解析】(1)水属于弱电解质,存在电离平衡:H2OH++OH—。所以不论是酸还是碱均是抑制水的电离,②和④中氢离子和OH—的的浓度均相同,抑制水的电离程度是相同的,所以由水电离出来的c(H+)是相同的。
(2)盐酸的浓度是0.01mol/L,氨水是弱电解质,所以其浓度大于0.01mol/L,因此反应后氨水是过量的,溶液显碱性,pH大于7.
(3)。强碱每稀释10n倍,强碱的pH就减小n个单位,所以pH=12的氢氧化钠稀释10倍,pH=11。但醋酸是弱电解质,稀释10倍后溶液的pH将大于3,所以它们的pH之和小于14.
(4)300mlpH=12的氢氧化钠,其物质的量是0.01mol/L×0.3L=0.003mol。44.8 mL C02(标准状况)气体的物质的量是0.002mol,所以二者混合反应后生成物是碳酸钠和碳酸氢钠的混合液,其中二者的物质的量均是0.001mol。CO32-的水解程度大于HCO3-的水解程度,所以选项C错误,D正确。选项A符合电荷守恒,选项B符合物料守恒,均正确。
查看习题详情和答案>>
(9分)pH=12的NaOH溶液100ml,要使它的pH为11。(体积变化忽略不计)
(1)如果加入蒸馏水,应加 mL。
(2)如果加入pH=10的NaOH溶液,就加 mL。
(3)如果加0.01mol/L的HC1,应加 mL。
【解析】考查pH的计算。
(1)若加水稀释。强碱每稀释10n倍,强碱的pH就减小n个单位,pH由12变为11,则相当于稀释10倍,及最终溶液的体积是1000ml,所以需要水1000ml-100ml=900ml。
(2)若加入强碱。PH=11,则混合后OH-的物质的量浓度为0.001mol/L。所以有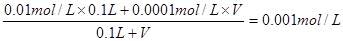 ,解得V=1L.
,解得V=1L.
(3)若加入盐酸,则发生中和反应。因此 ,解得V=0.0818L。
,解得V=0.0818L。
查看习题详情和答案>>