摘要:1mol甲基(一CH3)所含的电子数应为9NA,铜锌原电池中正极上生成0.1molH2.需得到0.2mol电子.所以电路中通过的电子也是0.2NA, NO与O2在标况下反应生成NO2.根据反应的化学方程式可以计算出生成的NO2为0.5mol.剩余的O2为0.25mol.即气体的总的物质的量为0.75mol.但NO2还有一个平衡:2NO2 N2O4.而此平衡的存在就使气体的总的分子数小于0.75mol,O3是氧的单质.所以16gO3中所含只有氧原子.氧原子个数为NA,C10H22分子中 C-H 有22个.C- C 9个共31个共价键,氯气只作氧化剂时.1 mol Cl2发生反应.转移的电子为2mol.但在发生歧化反应时.情况就有所不同了.例如.氯气与水反应时.1 mol Cl2发生反应时.转移的电子为1mol,标准状况下.水呈液态.故22.4L的水并不是1mol.[答案]C.
网址:http://m.1010jiajiao.com/timu_id_58183[举报]
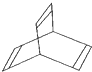 Ⅰ、有机物的结构可用“键线式”简化表示,如:CH3一CH=CH-CH3可表示为
Ⅰ、有机物的结构可用“键线式”简化表示,如:CH3一CH=CH-CH3可表示为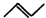 ,有一种有机物X的键线式如图所示.
,有一种有机物X的键线式如图所示.(1)X的分子式为
C8H8
C8H8
;(2)有机物Y是X的同分异构体,且属于芳香族化合物,则Y的结构简式是


(3)Y可以与溴水反应,该反应的化学方程式是


Ⅱ、玫瑰的香味物质中包含苧烯,苧烯的键线式为:
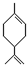
(1)1mol苧烯最多可以跟
2
2
molH2发生反应;(2)有机物A是苧烯的同分异构体,分子结构可表示为
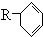 (R代表烃基),写出A可能的结构简式有
(R代表烃基),写出A可能的结构简式有4
4
种;(3)写出A(用
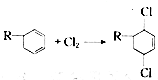
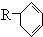 表示) 和Cl2发生1,4加成反应的化学方程式
表示) 和Cl2发生1,4加成反应的化学方程式