摘要:①根据上表数据绘制0.1000mol/L NaOH溶液滴定20.00mL0.1000mol/L 醋酸(HAc)溶液的滴定曲线. ②根据本题数据.确定pH的突变范围是 .③下列指示剂中适合于本实验的是 .A.甲基橙 B.石蕊 C.酚酞
网址:http://m.1010jiajiao.com/timu_id_577022[举报]
酸碱中和滴定常用于测定酸碱溶液的浓度。
(1)实践中,在正式测定前,常常用已知浓度的酸(或碱)滴定已知浓度的碱(或酸),测定滴定曲线,然后选择合适的指示剂指示滴定终点,以保证数据的准确性。如:用0.100 0 mol/L NaOH溶液滴定20.00 mL 0.100 0 mol/L醋酸(CH3COOH) 溶液,有关数据记录如下表:
| V/(NaOH)/mL | 0.00 | 10.00 | 18.00 | 19.80 | 19.98 | 20.00 | 20.02 | 20.20 | 22.00 | 40.00 |
| 溶液pH | 2.87 | 4.74 | 5.70 | 6.74 | 7.74 | 8.72 | 9.70 | 10.70 | 11.70 | 12.50 |
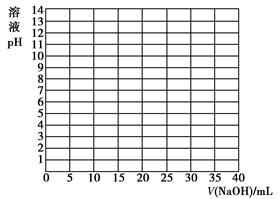
②根据你所绘制的曲线,确定pH的突变范围是________。
③下列指示剂中适合于本实验的是________。(填序号)
A.甲基橙 B.石蕊 C.酚酞
判断到达滴定终点的实验现象
(2)滴定过程中,眼睛应重点观察_ _。 查看习题详情和答案>>
用中和滴定法测定烧碱的纯度,若烧碱中含有少量不与酸作用的可溶性杂质,试根据实验回答:
(1)准确称取4.1g烧碱样品.
(2)将样品配成250mL待测液,需要的仪器有小烧杯、玻璃棒、
(3)用
(4)用0.2010mol?L-1标准盐酸滴定待测烧碱溶液,滴定时
(5)若两次实验滴定的数据如下表:
根据上表数据,计算待测烧碱溶液的浓度:
(6)根据上述各数据,计算烧碱的纯度:
(7)滴定时,滴定管尖嘴部分滴定前有气泡,滴定终了无气泡,测定结果将
查看习题详情和答案>>
(1)准确称取4.1g烧碱样品.
(2)将样品配成250mL待测液,需要的仪器有小烧杯、玻璃棒、
250mL容量瓶
250mL容量瓶
、胶头滴管.(3)用
碱式滴定管
碱式滴定管
量取10mL待测液于锥形瓶
锥形瓶
中(填仪器名称),并滴加几滴甲基橙作指示剂.(4)用0.2010mol?L-1标准盐酸滴定待测烧碱溶液,滴定时
左
左
手旋转酸
酸
式滴定管的玻璃活塞,右
右
手不停地摇动锥形瓶,两眼注视锥形瓶内溶液颜色的变化,直到滴定终点,滴定终点时锥形瓶内溶液的PH约为3.1~4.4
3.1~4.4
,达到终点的具体现象是:溶液由黄色变为橙色,且半分钟不变色
溶液由黄色变为橙色,且半分钟不变色
.(5)若两次实验滴定的数据如下表:
| 滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 10.00 | 0.50 | 20.4 |
| 第二次 | 10.00 | 4.00 | 24.1 |
0.4020 mol?L-1
0.4020 mol?L-1
.(6)根据上述各数据,计算烧碱的纯度:
98.05%
98.05%
(7)滴定时,滴定管尖嘴部分滴定前有气泡,滴定终了无气泡,测定结果将
偏高
偏高
(填偏高、偏低或无影响,其它操作均正确).硼镁泥是一种工业废料,主要成份是MgO(占40%),还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质,以此为原料制取的硫酸镁,可用于印染、造纸、医药等工业.从硼镁泥中提取MgSO4?7H2O的流程如下:
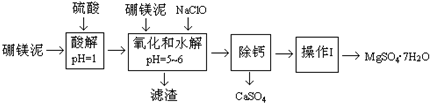
根据题意回答问题:
(1)实验中需用1mol/L的硫酸800mL,若用98%的浓硫酸(ρ=1.84g/mL)来配制,量取浓硫酸时,需使用的量筒的规格为
A.10mL B.20mL C.50mL D.100mL
(2)加入的NaClO可与Mn2+反应:Mn2++ClO-+H2O→MnO2↓+2H++Cl-,还有一种离子也会被NaClO氧化,该反应的离子方程式为 .
(3)滤渣的主要成份除含有Fe(OH)3、Al(OH)3外,还有 .
(4)在“除钙”前,需检验滤液中Fe3+是否被除尽,简述检验方法 .
(5)已知MgSO4、CaSO4的溶解度如下表:
“除钙”是将MgSO4和CaSO4混合溶液中的CaSO4除去,根据上表数据,简要说明操作步骤 .“操作I”是将滤液继续蒸发浓缩,冷却结晶, ,便得到了MgSO4?7H2O.
(6)实验中提供的硼镁泥共100g,得到的MgSO4?7H2O为172.2g,则MgSO4?7H2O的产率为 .
查看习题详情和答案>>

根据题意回答问题:
(1)实验中需用1mol/L的硫酸800mL,若用98%的浓硫酸(ρ=1.84g/mL)来配制,量取浓硫酸时,需使用的量筒的规格为
A.10mL B.20mL C.50mL D.100mL
(2)加入的NaClO可与Mn2+反应:Mn2++ClO-+H2O→MnO2↓+2H++Cl-,还有一种离子也会被NaClO氧化,该反应的离子方程式为
(3)滤渣的主要成份除含有Fe(OH)3、Al(OH)3外,还有
(4)在“除钙”前,需检验滤液中Fe3+是否被除尽,简述检验方法
(5)已知MgSO4、CaSO4的溶解度如下表:
| 温度(℃) | 40 | 50 | 60 | 70 |
| MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
| CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
(6)实验中提供的硼镁泥共100g,得到的MgSO4?7H2O为172.2g,则MgSO4?7H2O的产率为
工业上由FeS2制H2SO4的转化关系如下:
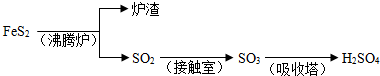
填写下列空白:
(1)已知吸收塔中每40gSO3气体被水完全吸收生成液态硫酸放出65.15kJ,写出该反应的热化学方程式
(2)接触室内发生的反应为:
SO2(g)+
O2(g)
SO3(g)△H=a kJ?mol-1
下表为不同温度(T)下该反应的化学平衡常数(K):
①根据上表数据及化学平衡理论,上述反应中a
②K值越大,表明反应达到平衡时
A.SO2的转化率一定越高 B.SO3的产量一定越大
C.正反应进行得越完全 D.化学反应速率越大
(3)考虑综合经济效益,当炉渣含铁量大于45%时,可用于制硫酸亚铁等.下列利用炉渣里的Fe2O3制FeSO4的方案中,最能体现绿色化学理念的方案是
A.Fe2O3
Fe
FeSO4;B.Fe2O3
Fe2(SO4)3
FeSO4;C.Fe2O3
Fe
FeSO4
(4)为了探究接触室里催化剂颗粒(粗颗粒和细颗粒),反应的温度(673K和723K),反应的压强(101Kpa和1010Kpa)对反应速率的影响,通过变换这些实验条件,至少需要完成
(5)为实现绿色环保、节能减排和废物利用等目的,某硫酸厂用碳酸钙作吸收剂与水配成浆液,洗涤尾气(SO2的体积分数为0.200%)并吸收SO2,得到石膏(CaSO4?2H2O).求:22.4m3(标准状况下)的尾气可制得石膏
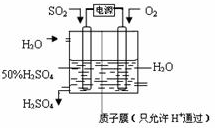
(6)科学家研究出以图所示装置用电化学原理生产硫酸的新工艺,其阳极的电极反应式为
查看习题详情和答案>>

填写下列空白:
(1)已知吸收塔中每40gSO3气体被水完全吸收生成液态硫酸放出65.15kJ,写出该反应的热化学方程式
SO3(g)+H2O(l)=H2SO4(l)△H=-130.3kJ/mol
SO3(g)+H2O(l)=H2SO4(l)△H=-130.3kJ/mol
;(2)接触室内发生的反应为:
SO2(g)+
| 1 |
| 2 |
| ||
| △ |
下表为不同温度(T)下该反应的化学平衡常数(K):
| T/K | 673 | 723 | 823 | 923 |
| K | 423 | 37.4 | 20.5 | 4.68 |
<
<
0(填“>”或“<”);②K值越大,表明反应达到平衡时
C
C
(填标号).A.SO2的转化率一定越高 B.SO3的产量一定越大
C.正反应进行得越完全 D.化学反应速率越大
(3)考虑综合经济效益,当炉渣含铁量大于45%时,可用于制硫酸亚铁等.下列利用炉渣里的Fe2O3制FeSO4的方案中,最能体现绿色化学理念的方案是
B
B
(填标号);A.Fe2O3
| ||
| 高温 |
| 浓硫酸 |
| 浓硫酸 |
| 铁屑 |
| 铁粉 |
| 高温 |
| 浓硫酸 |
(4)为了探究接触室里催化剂颗粒(粗颗粒和细颗粒),反应的温度(673K和723K),反应的压强(101Kpa和1010Kpa)对反应速率的影响,通过变换这些实验条件,至少需要完成
4
4
个实验然后进行对比得出结论;(5)为实现绿色环保、节能减排和废物利用等目的,某硫酸厂用碳酸钙作吸收剂与水配成浆液,洗涤尾气(SO2的体积分数为0.200%)并吸收SO2,得到石膏(CaSO4?2H2O).求:22.4m3(标准状况下)的尾气可制得石膏
0.28
0.28
千克;(取两位有效数字)(设二氧化硫的利用率为80.0% )(6)科学家研究出以图所示装置用电化学原理生产硫酸的新工艺,其阳极的电极反应式为
SO2+2H2O-2e-=SO42-+4H+
SO2+2H2O-2e-=SO42-+4H+
,总反应的化学方程式为2SO2+O2+2H2O=2H2SO4
2SO2+O2+2H2O=2H2SO4
.
硼镁泥是一种工业废料,主要成分是MgO(约占40%),还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质,以此为原料制取的硫酸镁,可用于印染、造纸、医药等工业.从硼镁泥中提取MgSO4?7H2O的流程如图:

(1)实验中需要1.00mol/L的硫酸1000mL,若用98%的浓硫酸(p=1.84g/mL)来配制.下列所给的容器中,属于配制该硫酸溶液必须使用的有
A.容量瓶B.分液漏斗C.蒸馏烧瓶D.烧杯E.玻璃棒F.天平
(2)加入的NaClO可与Mn2+反应:Mn2++ClO-+H2O=MnO2↓+2H++Cl+,还有一种离子也会被NaClO氧化,该反应的离子方程式为
(3)滤渣的主要成分除含有Fe(OH)3、Al(OH)3外,还含有
(4)除去滤渣之前,往往还要加入一定量的硼镁泥,其原因可能是
(5)已知MgSO4、CaSO4的溶解度如下表
“除钙”是将MgSO4和CaSO4混合溶液中的CaSO4除去,根据上表数据简要说明操作步骤
(6)“操作Ⅰ”是将滤液继续蒸发浓缩,冷却结晶,
查看习题详情和答案>>

(1)实验中需要1.00mol/L的硫酸1000mL,若用98%的浓硫酸(p=1.84g/mL)来配制.下列所给的容器中,属于配制该硫酸溶液必须使用的有
A、D、E
A、D、E
(填写选项字母)A.容量瓶B.分液漏斗C.蒸馏烧瓶D.烧杯E.玻璃棒F.天平
(2)加入的NaClO可与Mn2+反应:Mn2++ClO-+H2O=MnO2↓+2H++Cl+,还有一种离子也会被NaClO氧化,该反应的离子方程式为
2Fe2++ClO-+2H+=2Fe3++Cl-+H2O或2Fe2++HClO+H+=2Fe3++Cl-+H2O
2Fe2++ClO-+2H+=2Fe3++Cl-+H2O或2Fe2++HClO+H+=2Fe3++Cl-+H2O
(3)滤渣的主要成分除含有Fe(OH)3、Al(OH)3外,还含有
MnO2、SiO2
MnO2、SiO2
(4)除去滤渣之前,往往还要加入一定量的硼镁泥,其原因可能是
调节溶液pH,使Fe3+、Al3+水解完全,除去多余的NaClO
调节溶液pH,使Fe3+、Al3+水解完全,除去多余的NaClO
(5)已知MgSO4、CaSO4的溶解度如下表
| 温度(°C) | 40 | 50 | 60 | 70 |
| MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
| CaSO4 | 0.210 | 0.207 | 0.201 | 0.197 |
蒸发浓缩,趁热过滤
蒸发浓缩,趁热过滤
(6)“操作Ⅰ”是将滤液继续蒸发浓缩,冷却结晶,
过滤(或过滤洗涤)
过滤(或过滤洗涤)
,便得到了MgSO4?7H2O.