网址:http://m.1010jiajiao.com/timu_id_576630[举报]
一.选择题(本题包括8小题,每小题3分,共24分)
题号
1
2
3
4
5
6
7
8
答案
A
D
B
C
B
A
C
D
二.选择题(本题包括8小题,每小题3分,共24分)
题号
9
10
11
12
13
14
15
16
答案
B
AC
C
BC
AD
C
AD
D
三.(本题包括2小题,共20分)
17.(共8分)
(1)Cu+4H++2NO3-=Cu2++2NO2↑+2H2O (2分)
(2)①不易控制反应。②产生有毒气体,造成污染环境。(2分)
(3)c; a、b。(2分)
(4)关闭a, b,打开c (1分) 用手捂住(热水、热毛巾、加热)试管② (1分)
(合理答案均给分)
18.(每空2分,共12分)
实验一:(1)反应物本身的性质对反应速率的关系;(2分)
温度相同;(2分)
(2)Mg(或Fe)和0.5mol/L硫酸和2mol/L硫酸;(2分)
测定一定时间产生气体的体积(或者测定一定体积的气体所需时间);(2分)
实验二:(1)催化剂(或硫酸锰或Mn2+的催化作用);(2分)
 (2)B
(2分)
(2)B
(2分)
四.(本题包括2小题,共20分)
19.(每空2分,共10分)
(1)0.1;(2)1.69;
(3)①c;②(参看右图)
(4)0<c(A)<0.2mol/L;(5)B
20.(每空2分,共10分)
(1) (2分)
(2分)
(2)均为氧化还原反应 (2分)
(3)3Fe+ 4H2O  Fe 3O4+4H2↑
(2分)
Fe 3O4+4H2↑
(2分)
(4)Fe+4H++2NO3-=Fe2++2NO2↑+2 H2O (2分)
(5)取少量样品于试管中,加入KSCN溶液,如果出现红色,说明变质;反之,没有变质 (2分)
五.(本题包括1小题,共12分)
21.(共12分)
(1)1S22S22P6;(2分)(2)H2S或NH2-;(2分)
(3)A;(2分)(4)BC;(2分)(5)20; (2分)
(6)Cu2++4H2O=[Cu(H2O)4]2+ (2分)
六.(本题包括1小题,共10分)
22.(共10分)
(1)B (2分)
(2)2H2O 2H2↑+O2↑
(2分)
2H2↑+O2↑
(2分)
(3) SO2+I2+2H2O 2HI+H2SO4 (2分)
2HI+H2SO4 (2分)
SO2和I2可循环使用,无污染。 (2分)
(4)不现实,理由是现有的制取氢气方法耗能大,制取的成本太高,另外是氢气的熔沸点太低,给储存和运输带来困难。(或:现实,制取氢气用水为原料,来源丰富;氢气燃烧的产物是水,不会给环境带来任何污染等。) (2分)
 七.(本题包括1小题,共10分)
七.(本题包括1小题,共10分)
23.(10分)
(1)134.4;
(2) (参看右图);
(3)0.068mol;
(4)
说明:本试卷中其他合理答案同样给分。
(10分)影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究。
实验一:他们利用Cu、Fe、Mg和不同浓度的硫酸(0.5mol/L、2mol/L、18.4mol/L),设计实验方案来研究影响反应速率的因素。
甲同学研究的实验报告如下表:
| 实 验 步 骤 | 现 象 | 结 论 |
| ①分别取等体积的2 mol/L硫酸于试管中; ②分别投入大小、形状相同的Cu、Fe、Mg。 | 反应快慢: Mg>Fe>Cu | 反应物的性质越活泼, 反应速率越快。 |
要得出正确的实验结论,还需控制的实验条件是 。
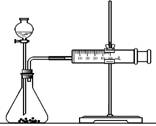
(2)乙同学为了更精确地研究浓度对反应速率的影响,利用下图装置进行定量实验。完成该实验应选用的实验药品可以是(从题中所给药品中挑选) ;
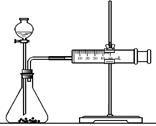
实验二:
已知: 2KMnO4+5H2C2O4+3H2SO4 = K2SO4+2MnSO4+8H2O+10CO2↑,在高锰酸钾酸性溶液和草酸溶液反应时,发现开始一段时间,反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快。
(1)针对上述实验现象,某同学认为KMnO4与H2C2O4反应是放热反应,导致溶液温度升高,反应速率加快。从影响化学反应速率的因素看,你的猜想还可能是_______________的影响。
(2)若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液试剂外,还需要选择的试剂最合理的是 。
A.硫酸钾 B.硫酸锰 C.氯化锰 D.水 查看习题详情和答案>>
影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究。
实验一:他们利用Cu、Fe、Mg和不同浓度的硫酸(0.5mol/L、2mol/L、18.4mol/L),设计实验方案来研究影响反应速率的因素。
(1)甲同学研究的实验报告如下表:
| 实 验 步 骤 | 现 象 | 结 论 |
| ①分别取等体积的2 mol/L硫酸于试管中; ②分别投入大小、形状相同的Cu、Fe、Mg。 | 反应快慢: Mg>Fe>Cu | 反应物的性质越活泼,反应速率越快。 |
(2)乙同学为了更精确地研究浓度对反应速率的影响,利用下图装置进行定量实验。完成该实验应选用的实验药品是_____________;应该测定的实验数据是________________________。

实验二:已知2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10CO2↑,在高锰酸钾酸性溶液和草酸溶液反应时,发现开始一段时间,反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快。
(1)针对上述实验现象,某同学认为KMnO4与H2C2O4反应是放热反应,导致溶液温度升高,反应速率加快。从影响化学反应速率的因素看,你的猜想还可能是______________的影响。
(2)若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液试剂外,还需要选择的试剂最合理的是______。
A、硫酸钾 B、硫酸锰 C、水 D、氯化锰 查看习题详情和答案>>
影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究。
实验一:他们利用Cu、Fe、Mg和不同浓度的硫酸(0.5mol/L、2mol/L、18.4mol/L),设计实验方案来研究影响反应速率的因素。
(1)甲同学研究的实验报告如下表:
|
实 验 步 骤 |
现 象 |
结 论 |
|
①分别取等体积的2 mol/L硫酸于试管中; ②分别投入大小、形状相同的Cu、Fe、Mg。 |
反应快慢: Mg>Fe>Cu |
反应物的性质越活泼,反应速率越快。 |
该同学的实验目的是研究____________对反应速率的影响;根据控制变量法,要得出正确的实验结论,还需控制的实验条件是保持______________条件相同。
(2)乙同学为了更精确地研究浓度对反应速率的影响,利用下图装置进行定量实验。完成该实验应选用的实验药品是_____________;应该测定的实验数据是________________________。

实验二:已知2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10CO2↑,在高锰酸钾酸性溶液和草酸溶液反应时,发现开始一段时间,反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快。
(1)针对上述实验现象,某同学认为KMnO4与H2C2O4反应是放热反应,导致溶液温度升高,反应速率加快。从影响化学反应速率的因素看,你的猜想还可能是______________的影响。
(2)若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液试剂外,还需要选择的试剂最合理的是______。
A、硫酸钾 B、硫酸锰 C、水 D、氯化锰
查看习题详情和答案>>
(10分)影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究。
实验一:他们利用Cu、Fe、Mg和不同浓度的硫酸(0.5mol/L、2mol/L、18.4mol/L),设计实验方案来研究影响反应速率的因素。
甲同学研究的实验报告如下表:
|
实 验 步 骤 |
现 象 |
结 论 |
|
①分别取等体积的2 mol/L硫酸于试管中; ②分别投入大小、形状相同的Cu、Fe、Mg。 |
反应快慢: Mg>Fe>Cu |
反应物的性质越活泼, 反应速率越快。 |
(1)该同学的实验目的是 ;
要得出正确的实验结论,还需控制的实验条件是 。
(2)乙同学为了更精确地研究浓度对反应速率的影响,利用下图装置进行定量实验。完成该实验应选用的实验药品可以是(从题中所给药品中挑选) ;
实验二:
已知: 2KMnO4+5H2C2O4+3H2SO4 = K2SO4+2MnSO4+8H2O+10CO2↑,在高锰酸钾酸性溶液和草酸溶液反应时,发现开始一段时间,反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快。
(1)针对上述实验现象,某同学认为KMnO4与H2C2O4反应是放热反应,导致溶液温度升高,反应速率加快。从影响化学反应速率的因素看,你的猜想还可能是_______________的影响。
(2)若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液试剂外,还需要选择的试剂最合理的是 。
A.硫酸钾 B.硫酸锰 C.氯化锰 D.水
查看习题详情和答案>>
影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究。
实验一:他们利用Cu、Fe、Mg和不同浓度的硫酸(0.5mol/L、2mol/L、18.4mol/L),设计实验方案来研究影响反应速率的因素。
甲同学研究的实验报告如下表:
| 实 验 步 骤 | 现 象 | 结 论 |
| ①分别取等体积的2 mol/L硫酸于试管中; ②分别投入大小、形状相同的Cu、Fe、Mg。 | 反应快慢: Mg>Fe>Cu | 反应物的性质越活泼, 反应速率越快。 |
 (1)该同学的实验目的是 ;
(1)该同学的实验目的是 ;
要得出正确的实验结论,还需控制的实验条件是 。
(2)乙同学为了更精确地研究浓度对反应速率的影响,利用右图装置进行定量实验。完成该实验应选用的实验药品可以是(从题中所给药品中挑选)
;
实验二:
已知: 2KMnO4+5H2C2O4+3H2SO4 = K2SO4+2MnSO4+8H2O+10CO2↑,在高锰酸钾酸性溶液和草酸溶液反应时,发现开始一段时间,反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快。
(1)针对上述实验现象,某同学认为KMnO4与H2C2O4反应是放热反应,导致溶液温度升高,反应速率加快。从影响化学反应速率的因素看,你的猜想还可能是_______________的影响。
(2)若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液试剂外,还需要选择的试剂最合理的是 。
A.硫酸钾 B.硫酸锰 C.氯化锰 D.水
查看习题详情和答案>>