网址:http://m.1010jiajiao.com/timu_id_573551[举报]
1、B 2、D 3、B 4、C 5、D 6.D 7.D 8.A 9.B 10.A 11.A 12.B 13.D
14、C 15、ACD 16、B 17、C 18、A 19、D 20、A 21、CD
22. (1)C ; 0.600 ;(2)0.92;2.76;7.22;6.78(3)(1)BCE (2)4.3
23.

 2424.
2424.
24.解:当加速电压为U1时电子到达O点速度为
 ,则
,则 =
= ① (2分)
① (2分)
电子在偏转电场时有 ② (2分)
② (2分)
 ③(1分)
③(1分)
当加速电压为U2时电子到达O点速度为
 ,则
,则 ④(2分)
④(2分)
电子刚飞出偏转时偏移量: ⑤(2分)
⑤(2分)  ⑥(1分)
⑥(1分)
如图,由三角形相似有 ⑦ (4分)
⑦ (4分)
所以  (2分)
(2分)  (2分)
(2分)
25.(1)A与B第一次碰前: (2分)
(2分)
A与B第一次碰撞  (2分)
(2分)
 (2分)
(2分)
所以
 (2分)
(2分)
(2)B、C第一次碰撞  所以
所以 即B碰后停下 (2分)
即B碰后停下 (2分)
BC第一次碰前 (2分)
(2分)
此时 (2分)
(2分)
AB第一次碰后到第二次相碰前  (2分)
(2分)
所以 (2分)
(2分)
第二次相碰前 =
= (2分)
(2分)
W= (2分)
(2分)
26.(10分)
⑴ F Al (各2分) ⑵  (3分)
(3分)
⑶ 2Al + 2OH― + 2H2O=2AlO2― + 3H2↑(3分)
27.(20分)
⑴ C D(2分)
⑵ A D(2分)
⑶ 压强更高,所需动力更大,对材料的强度和设备的制造要求也更高。(2分)
⑷ 合成氨反应是可逆反应,实际消耗的N2(或H2)少于10 mol(或30 mol)(2分)
⑸①将注射器取下置于盛水的水槽中,若水进入注射器,气体体积减少,则说明有氨气生成。(2分)
② A B D(2分)
⑹①上述待测氨水 确保氨水的浓度不发生改变(各1分)
② 0.6250 mol/L(2分)
③ A C (1分)
⑺ N2 + 6e―=2N3―(2分)
28.(18分)
⑴  (各2分) ⑵ NaNH2 + NH4Cl=NaCl +
2NH3 (2分)
(各2分) ⑵ NaNH2 + NH4Cl=NaCl +
2NH3 (2分)
⑶ ①②(各2分)
⑷  (3分) ⑸ 4 (2分) ⑹ 1
(2分)
(3分) ⑸ 4 (2分) ⑹ 1
(2分)
⑺ C6H15N3 O 3 + NH3→C6H12N4 + 3H2O(2分)
29.(12分)
⑴ ①②④(2分)
⑵ 羧基 碳碳双键(各2分)
⑶ (CH3)2 CHCH
⑷(CH3)2 CHCH2 O H+ HC O O H→(CH3)3 CC O O H +H2 O(2分)
30.(22分)
⑴CO2(2分)
⑵B处O2多于D处,D处CO2多于B处(2分)
⑶减少(2分) 增加(2分) 上升(2分)
⑷装置中CO2量越来越少,暗反应下降,导致ATP和NADPH积累,进而使光反应下降。(2分) 乳酸(2分)
⑸15NH3→氨基酸及蛋白质(或含15N的有机物)(2分)根瘤菌、大豆(2分)脱氨基(2分)
肝脏(1分) 尿素(1分)
Ⅱ.(8分)
⑴细胞核(1分) 蒸馏水(1分) 不同浓度的NaCl溶液(1分)
⑵核糖体、线粒体(2分)
⑶胰岛素(1分)
 ⑷骨髓中的造血干细胞
抗体(2分)
⑷骨髓中的造血干细胞
抗体(2分)
⑸⑼答案见右图。(2分)注:①缺少细胞膜、中心体、纺锤体或染色体数目不符等错误均不得分。②姐妹染色体形态应一致,每一条染色体的“两臂”应“甩向”赤道板,否则不得分。右图的“美观性”不作要求。
31.(12分)
⑴①实验前要先测定甲、乙鼠的体温 ②实验要有重复性,仅用两只小白鼠进行实验有一定的偶然性。③增加丙组与甲鼠处理方法相同但不破坏下丘脑。
⑵赞同。先做不破坏下丘脑的实验,再做破坏下丘脑后的实验,进行自身前后对照(2分)
⑶BD AC (2分,缺一不给分)
⑷甲状腺激素和肾上腺素(2分,缺一不给分)

(16分)I.将一定量NO2和N2O4的混合气体通入体积为1L的恒温密闭容器中,各物质浓度随时间变化的关系如图1所示。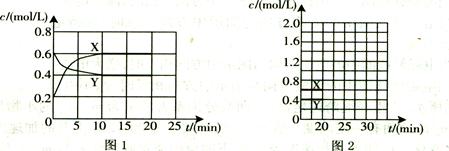
请回答:
(1)下列选项中不能说明该反应已达到平衡状态的是 (填选项字母)。
| A.容器内混合气体的压强不随时间变化而改变 |
| B.容器内混合气体的密度不随时间变化而改变 |
| C.容器内混合气体的颜色不随时间变化而改变 |
| D.容器内混合气体的平均相对分子质量不随时间变化而改变 |
;
(3)计算该反应的平衡常数K= 。
(4)反应进行到20 min时,再向容器内充入一定量NO2,10min后达到新的平衡,此
时测得c(NO2)="0.9" mol/L。
第一次平衡时混合气体中NO2的体积分数为w1,达到新平衡后混合气体中NO2的体积分数为w2,则w1 w2 (填“>”、“=”或“<”);
请在图2中画出20 min后各物质的浓度随时间变化的曲线(曲线上必须标出“X”和
“Y”)。
II.(1)海水中锂元素储量非常丰富,从海水中提取锂的研究极具潜力。锂是制造化学
电源的重要原料。如LiFePO4电池中某电极的工作原理如下图所示:
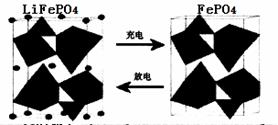
该电池的电解质为能传导Li+的固体材料。放电时该电极是电池的 极(填“正”或“负”),该电极反应式为 。
(2)用此电池电解含有0.1 mol/L CuSO4和0.1 mol/L NaCl的混合溶液100 mL,假如电路中转移了0.02 mol e-,且电解池的电极均为惰性电极,阳极产生的气体在标准状况下的体积是__________L. 查看习题详情和答案>>
|
NA表示阿伏加德罗常数,下列说法正确的是 | |
| [ ] | |
A. |
46 g NO2和N2O4的混合气体中,含氮原子数目是NA |
B. |
1.0 L 0.1 mol/L的NaF溶液中,含F-离子数目是0.1NA |
C. |
11.2 L的H2中,含有的电子数目是NA |
D. |
1 mol FeCl3跟沸水完全反应转化为氢氧化铁胶体,其中胶体粒子的数目是NA |
|
设NA为阿伏伽德罗常数的值,下列叙述中正确的是 | |
A. |
92 g NO2和N2O4混合气体中含有的原子数为6NA |
B. |
标准状况下,11.2 L SO3中含有的电子数为20NA |
C. |
0.5 mol/L的Ba(OH)2溶液中OH-的数目为NA |
D. |
1 mol Mg与足量的O2或N2反应生成MgO或Mg3N2时,失去的电子数均为2NA |
|
设NA为阿伏加德罗常数的值,下列叙述中正确的是 | |
| [ ] | |
A. |
92 g NO2和N2O4混合气体中含有的分子数为2NA |
B. |
标准状况下,11.2 L SO3中含有的电子数为20NA |
C. |
0.5 mol·L-1的Ba(OH)2溶液中OH-的数目为NA |
D. |
1 mol Mg与足量的O2或N2反应生成MgO或Mg3N2时,失去的电子数均为2NA |
用NA表示阿伏加德罗常数,下列说法中正确的是
A.84 g NaHCO3晶体中含有NA个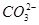 |
| B.9.2 g NO2和N2O4的混合气中含有的氮原子数为0.2NA |
| C.标准状况下,11.2 L臭氧中含NA个氧原子 |
| D.78 g Na2O2与足量的CO2反应,电子转移个数为2NA |