网址:http://m.1010jiajiao.com/timu_id_572135[举报]
I.关于反应物之间的定量关系的研究:
(1)已知反应:2I-+2Fe3+=I2+2Fe2+,向100mL,0.1moL?L-1的FeI2溶液中通入0.01mol Cl2,该反应的离子方程式为
(2)298K时,Mg(OH)2的溶度积常数Ksp=5.6×10-12,将物质的量浓度均为2×10-4mol?L-1的氯化镁溶液和氢氧化钠溶液等体积混合,能否产生氢氧化镁沉淀?
Ⅱ,关于反应速率、限度的研究:
近段时间,全国范围内的雾霾天气严重影响了人们的身体健康.环境问题越来越受到人们的重视.汽车尾气中含有较多的NO和CO,两种气体均会使人体中毒.以CO为例,其中毒原理是相同温度下CO与血红蛋白的结合能力远远大于氧气与血红蛋白的结合能力,反应如下:CO+HbO2?O2+HbCO(HbO2表示氧合血红蛋白).
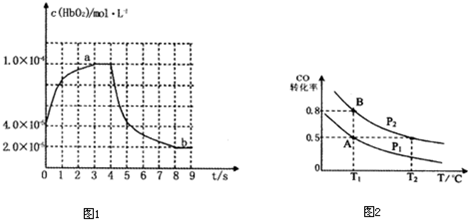
如图表示HbO2浓度随时间的变化:曲线a表示向血样中通入氧气后的变化;曲线b表示在第4s时通入CO和O2混合气体后的变化.
(3)前3s以HbO2表示的平均反应速率为
(4)37℃时,CO+HbO2?O2+HbCO,该反应的平衡常数K=220,资料显示HbCO的浓度达到HbO2浓度的0.022倍,就会导致人体智力受损.据此,通过计算可知,当吸入的CO与O2浓度之比大于或等于
| 1 |
| 10000 |
| 1 |
| 10000 |
(5)一氧化碳、氢气既是重要的能源,也可以催化还原NO等消除污染,还可以在一定条件下制取CH3OH.已知
N2(g)+O2(g)=2NO((g)△H=+180.5kJ?mol-1
2H2(g)+O2(g)=2H2O(1)△H=-571.6kJ?mol-1
H2O(g)=H2O(1)△H=-44kJ?mol-1
写出H2与NO反应生成N2和水蒸气的热化学方程式
(6)在一容积可变的密闭容器中充入10mol CO和20molH2,在催化剂存在时反应生成甲醇:CO(g)+2H2(g)?CH3OH(g),CO的平衡转化率随温度(T)、压强(P)的变化如右图所示,当达到平衡状态A时,容器的体积为10L.如反应开始时仍充入10mol CO和20mol H2,则在平衡状态B时容器的体积V(B)=
(1)关于反应物之间的定量关系的研究:已知反应:Br2+2Fe2+═2Br-+2Fe3+,向10mL 0.1mol?L-1的FeBr2溶液中通入0.001mol Cl2,该反应的离子方程式为:
(2)关于反应速率、限度的研究:
①已知298K时,Mg(OH)2的溶度积常数Ksp=5.6×10-12,在氯化镁溶液中加入一定量的烧碱,测得pH=13.0,则此温度下残留在溶液中的c(Mg2+)=
②科学研究发现纳米级的Cu2O可作为太阳光分解水的催化剂.一定温度下,在2L密闭容器中加入纳米级Cu2O并通入0.10mol水蒸气,发生反应:2H2O(g)
| Cu2O |
| 时间/min | 20 | 40 | 60 | 80 |
| n(O2)/mol | 0.0010 | 0.0016 | 0.0020 | 0.0020 |

③向某密闭容器中加入 0.3molA、0.1molC和一定量的B三种气体.一定条件下发生反应,各物质浓度随时间变化如下图中甲图所示.附图中乙图为t2时刻后改变容器中条件,平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件,所用条件均不同.已知,t3-t4阶段为使用催化剂[已知t0-t1阶段c(B)未画出].请回答:
I:t4-t5阶段改变的条件为
II:B的起始物质的量为
对于一个化学反应的研究需要从反应条件、限度、速率、定量关系等因素进行综合分析,下列是关于化学反应的系列研究,请根据相关信息回答问题。
⑴关于反应物之间的定量关系的研究:
已知反应:Br2 +2Fe2+=2 Br -+2Fe3+,向10 mL0 .1mol/L的Fe Br2溶液中通入0 .003mol Cl2,该反应的离子方程式为
⑵关于反应速率、限度的研究:
①已知298K时,Mg(OH)2的溶度积常数Ksp=5.6×10-12,在氯化镁溶液中加入一定量的烧碱,测得pH=13.0,则此温度下残留在溶液中的c(Mg 2+)=
②科学研究发现纳米级的Cu2O可作为太阳光分解水的催化剂。
一定温度下,在2L密闭容器中加入纳米级的Cu2O并通入0 .1mol水蒸气,发生反应:
 2 H2O(g)
2 H2O(g)
2 H2 (g) + O2(g) △H=+484kJ· mol-1,不同时段产生O2的量见下表:
|
时间/min |
20 |
40 |
60 |
80 |
|
n(O2)/mol |
0.0010 |
0.0016 |
0.0020 |
0.0020 |
则前20min的反应速率v(H2O)= ;达到平衡时,至少需要吸收的光能为 kJ。
③向某密闭容器中加入0 .3molA、0 .1molC和一定量的B三种气体。一定条件下发生反应,各物质浓度随时间变化如下图中甲图所示。附图中乙图为t2时刻后改变容器中条件,平衡体系中反应速率随时间变化的情况,且四个阶段都只改变一种条件。已知t3~t4为使用催化剂,甲图中t0~t1阶段c (B)未画出。请回答:

Ⅰ:t4~t5阶段改变的条件是 t5~t6阶段改变的条件是
Ⅱ:B的起始浓度为 ,该反应方程式为
查看习题详情和答案>>
(1)关于反应物之间的定量关系的研究:已知反应:Br2+2Fe2+═2Br-+2Fe3+,向10mL 0.1mol?L-1的FeBr2溶液中通入0.001mol Cl2,该反应的离子方程式为:______
(2)关于反应速率、限度的研究:
①已知298K时,Mg(OH)2的溶度积常数Ksp=5.6×10-12,在氯化镁溶液中加入一定量的烧碱,测得pH=13.0,则此温度下残留在溶液中的c(Mg2+)=______.
②科学研究发现纳米级的Cu2O可作为太阳光分解水的催化剂.一定温度下,在2L密闭容器中加入纳米级Cu2O并通入0.10mol水蒸气,发生反应:2H2O(g)
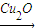 2H2(g)+O2(g)△H=+484kJ?mol-1不同时段产生O2的量见下表:
2H2(g)+O2(g)△H=+484kJ?mol-1不同时段产生O2的量见下表:| 时间/min | 20 | 40 | 60 | 80 |
| n(O2)/mol | 0.0010 | 0.0016 | 0.0020 | 0.0020 |
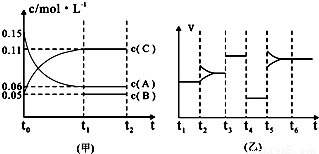
③向某密闭容器中加入 0.3molA、0.1molC和一定量的B三种气体.一定条件下发生反应,各物质浓度随时间变化如下图中甲图所示.附图中乙图为t2时刻后改变容器中条件,平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件,所用条件均不同.已知,t3-t4阶段为使用催化剂[已知t-t1阶段c(B)未画出].请回答:
I:t4-t5阶段改变的条件为______,
II:B的起始物质的量为______.
查看习题详情和答案>>
对一个化学反应的研究需要从反应条件、限度、速率、定量关系等因素进行综合分析,下列是关于化学反应的系列研究,请根据相关信息回答问题.
(1)关于反应物之间的定量关系的研究:已知反应:Br2+2Fe2+═2Br-+2Fe3+,向10mL 0.1mol?L-1的FeBr2溶液中通入0.001mol Cl2,该反应的离子方程式为:______
(2)关于反应速率、限度的研究:
①已知298K时,Mg(OH)2的溶度积常数Ksp=5.6×10-12,在氯化镁溶液中加入一定量的烧碱,测得pH=13.0,则此温度下残留在溶液中的c(Mg2+)=______.
②科学研究发现纳米级的Cu2O可作为太阳光分解水的催化剂.一定温度下,在2L密闭容器中加入纳米级Cu2O并通入0.10mol水蒸气,发生反应:2H2O(g)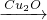 2H2(g)+O2(g)△H=+484kJ?mol-1不同时段产生O2的量见下表:
2H2(g)+O2(g)△H=+484kJ?mol-1不同时段产生O2的量见下表:
| 时间/min | 20 | 40 | 60 | 80 |
| n(O2)/mol | 0.0010 | 0.0016 | 0.0020 | 0.0020 |

③向某密闭容器中加入 0.3molA、0.1molC和一定量的B三种气体.一定条件下发生反应,各物质浓度随时间变化如下图中甲图所示.附图中乙图为t2时刻后改变容器中条件,平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件,所用条件均不同.已知,t3-t4阶段为使用催化剂[已知t0-t1阶段c(B)未画出].请回答:
I:t4-t5阶段改变的条件为______,
II:B的起始物质的量为______. 查看习题详情和答案>>