网址:http://m.1010jiajiao.com/timu_id_565363[举报]
一、选择题:
1.B 2.A 3.C 4.B 5.D 6.B 7.B 8.C 9.A 10.B 11.A 12.C
二、选择题:
13.B  14.BC 15.B 16.C.17.AD 18.BC 19.AB 20.C
14.BC 15.B 16.C.17.AD 18.BC 19.AB 20.C
三、
21.B C D E
22.⑴K2CO3 、AlCl3、BaCl2;
⑵产生白色沉淀,后沉淀逐渐溶解;
⑶①中;②Ba2++OH-+H++SO2- 4=BaSO4↓+H2O;③13
四、
23.本题答案有开放性,合理即可给分。
⑴①C(或Fe) ②
⑶①CaC2+2H2O=Ca(OH)2+C2H2↑ ;②麦芽糖;
⑷①Na2CO3+CO2+H2O=2NaHCO3 ;②红褐色固体。
24.
编号
1
2
3
4
5
X的化学式
Na
Na2O
Na2O2
NaOH
NaH
加入X的质量(g)
4.6
6.2
7.8
8.0
4.8
五、
25.(1)醛基;略(为羧基的结构式);
(2)氧化反应;酯化反应;

 (3)
(4)
(3)
(4)

六、
26.

(0, 0.7) (0.1, 0.4) (0.2, 0.3) (0.3, 0.4) (0.4, 0.7) (0.5, 0.7)
(每1折点1分,离子方程式每个1分)
 w.w.w.k.s.5.u.c.o.m
w.w.w.k.s.5.u.c.o.m
www.ks5u.com
 2NH3(g);△H=-92.4 kJ/mol;现有恒温、恒容且体积相同的两个密闭容器A、B,A中通入1mol N2、3mol H2,B中通入0.5mol N2、1.5mol H2,反应一段时间后,测得两个容器内压强均不再发生变化。下列判断正确的是
2NH3(g);△H=-92.4 kJ/mol;现有恒温、恒容且体积相同的两个密闭容器A、B,A中通入1mol N2、3mol H2,B中通入0.5mol N2、1.5mol H2,反应一段时间后,测得两个容器内压强均不再发生变化。下列判断正确的是B.B中放热46.2kJ
C.A中热量变化值一定大于B的2倍
D.A、B中N2的体积分数相同
利用N2和H2可以实现NH3的工业合成,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产。请回答下列问题:
(1)已知:N2(g) + O2(g) === 2NO(g) △H= +180.5kJ/mol
N2(g) + 3H2(g)  2NH3(g) △H=-92.4kJ/mol
2NH3(g) △H=-92.4kJ/mol
2H2(g) + O2(g) ="==" 2H2O(g) △H=-483.6kJ/mol
若有17 g氨气经催化氧化完全生成一氧化氮气体和水蒸气所放出的热量为______。
(2)某科研小组研究:在其他条件不变的情况下,改变起始物氢气的物质的量对N2(g)+3H2(g) 2NH3(g)反应的影响。
2NH3(g)反应的影响。
实验结果如图所示:(图中T表示温度,n表示物质的量)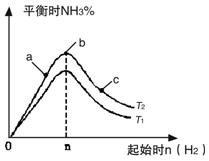
①图像中T2和T1的关系是:T2 ______T1(填“高于”、“低于”、
“等于”或“无法确定”)。
②比较在a、b、c三点所处的平衡状态中,反应物N2 的转化率最 高的是______(填字母)。
③在起始体系中加入N2的物质的量为________mol时,反应后氨的百分含量最大;若容器容积为1L,n=3mol反应达到平衡时H2的转化率为60%,则此条件下(T2),反应的平衡常数K=________________________。
(3)N2O5是一种新型硝化剂,其性质和制备受到人们的关注。
①一定温度下,在恒容密闭容器中N2O5可发生下列反应:
2N2O5(g)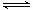 4NO2(g)+O2(g) ΔH>0下表为反应在T1温度下的部分实验数据
4NO2(g)+O2(g) ΔH>0下表为反应在T1温度下的部分实验数据
则500s内NO2的平均生成速率为 。
②现以H2、O2、熔融盐W#W$W%.K**S*&5^UNa2CO3组成的燃料电池,采用电解法制备N2O5,
装置如图所示,其中Y为CO2。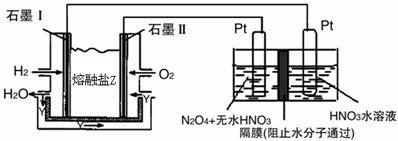
写出石墨I电极上发生反应的电极反应式 。
在电解池中生成N2O5的电极反应式为 。
利用N2和H2可以实现NH3的工业合成,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产。请回答下列问题:
(1)已知:N2(g) + O2(g) === 2NO(g) △H= +180.5kJ/mol
N2(g) + 3H2(g) ![]() 2NH3(g) △H=-92.4kJ/mol
2NH3(g) △H=-92.4kJ/mol
2H2(g) + O2(g) === 2H2O(g) △H=-483.6kJ/mol
若有17 g 氨气经催化氧化完全生成一氧化氮气体和水蒸气所放出的热量为______。
(2)某科研小组研究:在其他条件不变的情况下,改变起始物氢气的物质的量对N2(g)+3H2(g) ![]() 2NH3(g)反应的影响。
2NH3(g)反应的影响。
实验结果如图所示:(图中T表示温度,n表示物质的量)

①图像中T2和T1的关系是:T2 ______T1(填“高于”、“低于”、
“等于”或“无法确定”)。
②比较在a、b、c三点所处的平衡状态中,反应物N2 的转化率最 高的是______(填字母)。
③在起始体系中加入N2的物质的量为________mol时,反应后氨的百分含量最大;若容器容积为1L,n=3mol反应达到平衡时H2的转化率为60%,则此条件下(T2),反应的平衡常数K=________________________。
(3)N2O5是一种新型硝化剂,其性质和制备受到人们的关注。
①一定温度下,在恒容密闭容器中N2O5可发生下列反应:
2N2O5(g)![]() 4NO2(g)+O2(g) ΔH>0下表为反应在T1温度下的部分实验数据
4NO2(g)+O2(g) ΔH>0下表为反应在T1温度下的部分实验数据

则500s内NO2的平均生成速率为 。
②现以H2、O2、熔融盐W#W$W%.K**S*&5^UNa2CO3组成的燃料电池,采用电解法制备N2O5,
装置如图所示,其中Y为CO2。

写出石墨I电极上发生反应的电极反应式 。
在电解池中生成N2O5的电极反应式为 。
查看习题详情和答案>>利用N2和H2可以实现NH3的工业合成,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产。请回答下列问题:
(1)已知:N2(g)+O2(g) = 2NO(g) △H=+180.5kJ/mol
N2(g)+3H2(g) ![]() 2NH3(g) △H=-92.4kJ/mol
2NH3(g) △H=-92.4kJ/mol
2H2(g)+O2(g) = 2H2O(g) △H=-483.6kJ/mol
若有17 g 氨气经催化氧化完全生成一氧化氮气体和水蒸气所放出的热量为 。
 (2)某科研小组研究:在其他条件不变的情况下,改变起始物氢气的物质的量对N2(g)+3H2(g)
(2)某科研小组研究:在其他条件不变的情况下,改变起始物氢气的物质的量对N2(g)+3H2(g)![]() 2NH3(g)反应的影响。
2NH3(g)反应的影响。
实验结果如图所示:(图中T表示温度,n表示物质的量)
①图像中T2和T1的关系是:T2 T1(填“高于”“低于”“等于”“无法确定”)
②比较在a、b、c三点所处的平衡状态中,反应物N2 的转化率最高的是 (填字母)。
③在起始体系中加入N2的物质的量为 mol时,反应后氨的百分含量最大;若容器容积为1L,n=3mol反应达到平衡时H2的转化率为60%,则此条件下(T2),反应的平衡常数K= 。
(3)N2O5是一种新型硝化剂,其性质和制备受到人们的关注。
①一定温度下,在恒容密闭容器中N2O5可发生下列反应:
2N2O5(g)![]() 4NO2(g)+O2(g) ΔH>0下表为反应在T1温度下的部分实验数据
4NO2(g)+O2(g) ΔH>0下表为反应在T1温度下的部分实验数据
| t/s | 0 | 500 | 1000 |
| c(N2O5)/mol·L—1 | 5.00 | 3.52 | 2.48 |
则500s内NO2的平均生成速率为 。
②现以H2、O2、熔融盐Na2CO3组成的燃料电池,采用电解法制备N2O5,装置如图所示,其中Y为CO2。ks5u

写出石墨I电极上发生反应的电极反应式 。
在电解池中生成N2O5的电极反应式为 。
查看习题详情和答案>>(1)已知:N2(g) + O2(g) === 2NO(g) △H= +180.5kJ/mol
N2(g) + 3H2(g)
 2NH3(g) △H=-92.4kJ/mol
2NH3(g) △H=-92.4kJ/mol2H2(g) + O2(g) ="==" 2H2O(g) △H=-483.6kJ/mol
若有17 g氨气经催化氧化完全生成一氧化氮气体和水蒸气所放出的热量为______。
(2)某科研小组研究:在其他条件不变的情况下,改变起始物氢气的物质的量对N2(g)+3H2(g)
 2NH3(g)反应的影响。
2NH3(g)反应的影响。实验结果如图所示:(图中T表示温度,n表示物质的量)

①图像中T2和T1的关系是:T2 ______T1(填“高于”、“低于”、
“等于”或“无法确定”)。
②比较在a、b、c三点所处的平衡状态中,反应物N2 的转化率最 高的是______(填字母)。
③在起始体系中加入N2的物质的量为________mol时,反应后氨的百分含量最大;若容器容积为1L,n=3mol反应达到平衡时H2的转化率为60%,则此条件下(T2),反应的平衡常数K=________________________。
(3)N2O5是一种新型硝化剂,其性质和制备受到人们的关注。
①一定温度下,在恒容密闭容器中N2O5可发生下列反应:
2N2O5(g)
 4NO2(g)+O2(g) ΔH>0下表为反应在T1温度下的部分实验数据
4NO2(g)+O2(g) ΔH>0下表为反应在T1温度下的部分实验数据
则500s内NO2的平均生成速率为 。
②现以H2、O2、熔融盐Na2CO3组成的燃料电池,采用电解法制备N2O5,
装置如图所示,其中Y为CO2。

写出石墨I电极上发生反应的电极反应式 。
在电解池中生成N2O5的电极反应式为 。