摘要:(1)盐酸,由 黄色 变为 橙色 .(2)0.4000mol/L, 90.91%.(3)ABDG
网址:http://m.1010jiajiao.com/timu_id_555244[举报]
某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
①用0.1000mol/L的标准盐酸润洗酸式滴定管2~3次
②取标准盐酸注入酸式滴定管至“0”刻度以上2~3mL处
③把酸式滴定管固定好,调节滴定管尖嘴使之充满溶液
④制节液面至“0”域“0”刻度以下,记下读数
⑤取20.00mL待测NaOH溶液注入洁净的锥形瓶中,并加入2~3滴甲基橙试液
⑥把锥形瓶放在滴定管下面,用标准盐酸滴定至终点,记录读数
请回答下列问题:
(1)判断到达滴定终点的现象是
(2)根据下列数据:
则,待测烧碱溶液的浓度为
(3)若某同学在实验过程中,洗涤酸式滴定管后,末用标准液润洗,便装入标准液进行了实验,实验结果将
查看习题详情和答案>>
①用0.1000mol/L的标准盐酸润洗酸式滴定管2~3次
②取标准盐酸注入酸式滴定管至“0”刻度以上2~3mL处
③把酸式滴定管固定好,调节滴定管尖嘴使之充满溶液
④制节液面至“0”域“0”刻度以下,记下读数
⑤取20.00mL待测NaOH溶液注入洁净的锥形瓶中,并加入2~3滴甲基橙试液
⑥把锥形瓶放在滴定管下面,用标准盐酸滴定至终点,记录读数
请回答下列问题:
(1)判断到达滴定终点的现象是
锥形瓶中溶液的颜色由黄色变为橙色且保持30秒内不褪色
锥形瓶中溶液的颜色由黄色变为橙色且保持30秒内不褪色
.(2)根据下列数据:
| 滴定次序 | 待测液体积(mL) | 标准盐酸体积(mL) | |
| 滴定前读数 | 滴定后读数 | ||
| 第一次 | 20.00 | 0.50 | 25.40 |
| 第二次 | 20.00 | 4.00 | 29.10 |
0.0800
0.0800
mol/L.(3)若某同学在实验过程中,洗涤酸式滴定管后,末用标准液润洗,便装入标准液进行了实验,实验结果将
变大
变大
(填“变大”、“变小”或“不变”)某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液时,选择甲基橙作指示剂.请填写下列空白:
(1)用标准的盐酸溶液滴定待测的氢氧化钠溶液时,左手把握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视
(2)下列操作中可能使所测氢氧化钠溶液的浓度数值偏低的是
(A)酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸溶液
(B)滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥
(C)酸式滴定管在滴定前有气泡,滴定后气泡消失
(D)读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
(3)若滴定开始和结束时,酸式滴定管中的液面如图所示: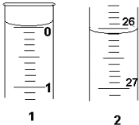 则起始读数为
则起始读数为
(4)某学生根据三次实验分别记录有关数据如表:
请选用其中合理的数据列式计算该氢氧化钠溶液的物质的量浓度:c(NaOH)=
查看习题详情和答案>>
(1)用标准的盐酸溶液滴定待测的氢氧化钠溶液时,左手把握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视
锥形瓶中溶液颜色变化
锥形瓶中溶液颜色变化
.直到因加入一滴盐酸后,溶液由黄色变为橙色,并半分钟内不复原
半分钟内不复原
为止.(2)下列操作中可能使所测氢氧化钠溶液的浓度数值偏低的是
D
D
(A)酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸溶液
(B)滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥
(C)酸式滴定管在滴定前有气泡,滴定后气泡消失
(D)读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
(3)若滴定开始和结束时,酸式滴定管中的液面如图所示:
 则起始读数为
则起始读数为0.00
0.00
mL,终点读数为26.10
26.10
mL;所用盐酸溶液的体积为26.10
26.10
mL.(4)某学生根据三次实验分别记录有关数据如表:
| 滴定次数 | 待测NaOH溶液的体积/mL | 0.1000mol/L盐酸的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
| 第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
| 第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
| 第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
0.1044mol/L
0.1044mol/L
(保留小数点后4位).(2012?琼海一模)中和滴定实验:
(1)取体积相同(25mL)的两份0.10mol/LNaOH溶液,将其中一份放在空气中一段时间后,溶液的pH
(2)某烧碱样品含少量不与酸作用的杂质,为了测定其纯度,进行以下滴定操作
A.在250mL的容量瓶中定容配成250mL烧碱溶液
B.用移液管移取25mL烧碱溶液于锥形瓶中并滴几滴指示剂甲基橙
C.在天平上准确称取烧碱样品Wg,在烧杯中用蒸馏水溶解
D.将物质的量浓度为C的标准硫酸溶液装入酸式滴定管,调节液面,记下开始读数为V1
E.在锥形瓶下垫一张白纸,滴定至终点,记下读数V2
回答下列各问题:
①正确操作步骤的顺序是(用字母填写)
②滴定前或滴定后读数时应注意
③E中在锥形瓶下垫一张白纸的作用是
④D步骤中液面应调节到
⑤滴定终点时颜色变化是
⑥若酸式滴定管不用标准硫酸润洗,在其它操作均正确的前提下,会使测定结果(指烧碱的纯度)
⑦该烧碱样品纯度的计算式为
%(注意:V为mL)
%(注意:V为mL).
查看习题详情和答案>>
(1)取体积相同(25mL)的两份0.10mol/LNaOH溶液,将其中一份放在空气中一段时间后,溶液的pH
减小
减小
(填“增大”“减小”或“不变”).用已知浓度的盐酸中和上述两份溶液.若中和放在空气中一段时间后的那份溶液消耗盐酸的体积为VA,中和另一份溶液消耗盐酸的体积为VB,则①以甲基橙为指示剂VA和VB的关系是VA=VB
VA=VB
.②以酚酞为指示剂时,VA和VB的关系是VB>VA
VB>VA
.(2)某烧碱样品含少量不与酸作用的杂质,为了测定其纯度,进行以下滴定操作
A.在250mL的容量瓶中定容配成250mL烧碱溶液
B.用移液管移取25mL烧碱溶液于锥形瓶中并滴几滴指示剂甲基橙
C.在天平上准确称取烧碱样品Wg,在烧杯中用蒸馏水溶解
D.将物质的量浓度为C的标准硫酸溶液装入酸式滴定管,调节液面,记下开始读数为V1
E.在锥形瓶下垫一张白纸,滴定至终点,记下读数V2
回答下列各问题:
①正确操作步骤的顺序是(用字母填写)
C
C
→A
A
→B
B
→D→E
E
.②滴定前或滴定后读数时应注意
滴定管要直立;装液或放液后需等1~2min后才能读数;读数时视线应与凹液面最低点平齐;读数应准确至0.1mL估至0.01mL
滴定管要直立;装液或放液后需等1~2min后才能读数;读数时视线应与凹液面最低点平齐;读数应准确至0.1mL估至0.01mL
.③E中在锥形瓶下垫一张白纸的作用是
便于准确判断终点时颜色的变化情况
便于准确判断终点时颜色的变化情况
.④D步骤中液面应调节到
调节到零刻度或零稍下的某一刻度
调节到零刻度或零稍下的某一刻度
,尖嘴部分应尖嘴部分应充满液体,无气泡
尖嘴部分应充满液体,无气泡
.⑤滴定终点时颜色变化是
由黄色变为橙色
由黄色变为橙色
.⑥若酸式滴定管不用标准硫酸润洗,在其它操作均正确的前提下,会使测定结果(指烧碱的纯度)
偏高
偏高
(指偏高、低或不变)⑦该烧碱样品纯度的计算式为
| 80(V2-V1)c |
| W |
| 80(V2-V1)c |
| W |
用中和滴定法测定烧碱的纯度,若烧碱中含有少量不与酸作用的可溶性杂质,试根据实验回答:
(1)准确称取4.1g烧碱样品.
(2)将样品配成250mL待测液,需要的仪器有小烧杯、玻璃棒、
(3)用
(4)用0.2010mol?L-1标准盐酸滴定待测烧碱溶液,滴定时
(5)若两次实验滴定的数据如下表:
根据上表数据,计算待测烧碱溶液的浓度:
(6)根据上述各数据,计算烧碱的纯度:
(7)滴定时,滴定管尖嘴部分滴定前有气泡,滴定终了无气泡,测定结果将
查看习题详情和答案>>
(1)准确称取4.1g烧碱样品.
(2)将样品配成250mL待测液,需要的仪器有小烧杯、玻璃棒、
250mL容量瓶
250mL容量瓶
、胶头滴管.(3)用
碱式滴定管
碱式滴定管
量取10mL待测液于锥形瓶
锥形瓶
中(填仪器名称),并滴加几滴甲基橙作指示剂.(4)用0.2010mol?L-1标准盐酸滴定待测烧碱溶液,滴定时
左
左
手旋转酸
酸
式滴定管的玻璃活塞,右
右
手不停地摇动锥形瓶,两眼注视锥形瓶内溶液颜色的变化,直到滴定终点,滴定终点时锥形瓶内溶液的PH约为3.1~4.4
3.1~4.4
,达到终点的具体现象是:溶液由黄色变为橙色,且半分钟不变色
溶液由黄色变为橙色,且半分钟不变色
.(5)若两次实验滴定的数据如下表:
| 滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 10.00 | 0.50 | 20.4 |
| 第二次 | 10.00 | 4.00 | 24.1 |
0.4020 mol?L-1
0.4020 mol?L-1
.(6)根据上述各数据,计算烧碱的纯度:
98.05%
98.05%
(7)滴定时,滴定管尖嘴部分滴定前有气泡,滴定终了无气泡,测定结果将
偏高
偏高
(填偏高、偏低或无影响,其它操作均正确).用中和滴定法测定某烧碱样品的纯度,试根据实验回答下列问题:
(1)准确称量8.2g含有少量中性易溶杂质的样品,配成500mL待测溶液.称量时,样品可放在
(A)小烧杯 (B)洁净纸片 (C)直接放在托盘上
(2)滴定时,用0.2000mol?L-1的盐酸来滴定待测溶液,不可选用
(A)甲基橙 (B)石蕊 (C)酚酞
(3)根据你所选择的指示剂,正确判断滴定终点的现象是:
(4)根据下表数据,计算被测烧碱溶液的物质的量浓度是
(5)下列实验操作会对滴定结果产生的后果.(填“偏高”、“偏低”或“无影响”)
①观察酸式滴定管液面时,开始俯视,滴定终点平视,则滴定结果
②若将锥形瓶用待测液润洗,然后再加入10.00mL待测液,则滴定结果
查看习题详情和答案>>
(1)准确称量8.2g含有少量中性易溶杂质的样品,配成500mL待测溶液.称量时,样品可放在
A
A
(填编号字母)上称量(A)小烧杯 (B)洁净纸片 (C)直接放在托盘上
(2)滴定时,用0.2000mol?L-1的盐酸来滴定待测溶液,不可选用
B
B
(填编号字母)作指示剂.(A)甲基橙 (B)石蕊 (C)酚酞
(3)根据你所选择的指示剂,正确判断滴定终点的现象是:
滴入最后一滴NaOH溶液时,溶液刚好由无色变为粉红(或由黄色变为橙色),且半分钟内不变色
滴入最后一滴NaOH溶液时,溶液刚好由无色变为粉红(或由黄色变为橙色),且半分钟内不变色
.(4)根据下表数据,计算被测烧碱溶液的物质的量浓度是
0.4000
0.4000
mol?L-1,烧碱样品的纯度是97.56%
97.56%
.| 滴定次数 | 待测溶液体积(mL) | 标准酸体积 | |
| 滴定前的刻度(mL) | 滴定后的刻度(mL) | ||
| 第一次 | 10.00 | 0.40 | 20.50 |
| 第二次 | 10.00 | 4.10 | 24.00 |
①观察酸式滴定管液面时,开始俯视,滴定终点平视,则滴定结果
偏高
偏高
.②若将锥形瓶用待测液润洗,然后再加入10.00mL待测液,则滴定结果
偏高
偏高
.