网址:http://m.1010jiajiao.com/timu_id_554937[举报]
题号
1
2
3
4
5
6
7
8
9
10
11
12
13
答案
D
B
B
B
C
D
C
C
C
A
A
BD
A
题号
14
15
16
17
18
19
20
21
22
23
24
25
答案
C
C
C
AD
BD
C
D
CD
C
C
D
A
26.(1)
(2)
 |
 (3)
(3)

(4)
27.(1) m+n < p 。(2) 固或液 。
(3) 逆向 。(4) 吸热 。
28. Cu , Cu-2e- = Cu 2+ ;
Ag , 2Ag++2e-= 2Ag 。
29. 4、6 , 3、8、9, 1 , 2 , 5 。
30.(1)蒸馏烧瓶 冷凝管 尾接管 锥形瓶
(2)①没有用石棉网 ② 温度计的水银球位置错误
③冷凝管进出水方向错误
(3)防止暴沸
(4)热稳定性较强,与杂质的沸点相差较大
31. 1−丁烯
1−丁烯
 2−丁烯
2−丁烯
 2−甲基丙烯
2−甲基丙烯
32.(1)
(2)阴极 
(3)6 mol/L
www.ks5u.com
已知:C(s)+CO2(g) 2CO(g);DH>0。该反应达到平衡后,下列条件有利于反应向正方向进行的是
2CO(g);DH>0。该反应达到平衡后,下列条件有利于反应向正方向进行的是
| A.升高温度和减小压强 | B.降低温度和减小压强 |
| C.降低温度和增大压强 | D.升高温度和增大压强 |
已知:C(s)+CO2(g) 2CO(g);DH>0。该反应达到平衡后,下列条件有利于反应向正方向进行的是
2CO(g);DH>0。该反应达到平衡后,下列条件有利于反应向正方向进行的是
A.升高温度和减小压强 B.降低温度和减小压强
C.降低温度和增大压强 D.升高温度和增大压强
查看习题详情和答案>>
(7 分 )水煤气 (主要成分:CO、H2 ) 是重要燃料和化工原料,可用水蒸气通过炽热的炭层制得:
C (s) + H2O(g)≒CO (g) +H2 (g);△H =+131.3kJ•mol-1
(1)某温度下,四个容器中均进行着上述反应,各容器中炭足量,其它物质的物质的量浓度及正逆反应速率关系如下表所示。请填写表中相应的空格。
|
容器编号 |
c(H2O)/mol·L-1 |
c(CO)/mol·L-1 |
c(H2)/mol·L-1 |
V正、V逆比较 |
|
I |
0.06 |
0.60 |
0.10 |
V正=V逆 |
|
II |
0.06 |
0.50 |
0.40 |
? |
|
III |
0.12 |
0.40 |
0.80 |
V正<V逆 |
|
IV |
0.12 |
0.30 |
? |
V正=V逆 |
(2)另有一个容积可变的密闭容器。恒温恒压下,向其中加入1.0mol炭和 1.0mo l水蒸气 (H216O),发生上述反应,达到平衡时,容器的体积变为原来的1.25 倍。平衡时水蒸气的转化率为 ;向该容器中补充 a mol 炭,水蒸气的转化率将 (填 “增大”、“减小”、“不变”),再补充 a mol 水蒸气 (H218O), 最终容器中C16O和C18O 的物质的量之比为 。
(3)己知:C (s) + 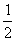 O2(g)=CO
(g);△H = -110.5kJ·mo1-1
O2(g)=CO
(g);△H = -110.5kJ·mo1-1
CO(g) + 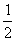 O2(g)
=CO2 (g);△H =-283.0 kJ·mo1-1
O2(g)
=CO2 (g);△H =-283.0 kJ·mo1-1
H2 (g) + 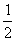 O2
(g) =H2O (g);△H = -241.8kJ·mo1-1
O2
(g) =H2O (g);△H = -241.8kJ·mo1-1
那么,将2.4 g 炭完全转化为水煤气,然后再燃烧,整个过程△H = kJ·mo1-1
查看习题详情和答案>>
(8分)水煤气 (主要成分:CO、H2 ) 是重要燃料和化工原料,可用水蒸气通过炽热的炭层制得。
己知:C (s) + H2O(g) ![]() CO (g) +H2 (g);△H =+131.3kJ•mol-1
CO (g) +H2 (g);△H =+131.3kJ•mol-1
C (s) + O2(g)=CO (g); △H = -110.5kJ·mo1-1
CO(g) + O2(g) =CO2 (g);△H =-283.0 kJ·mo1-1
H2 (g) + O2 (g) =H2O (g);△H = -241.8kJ·mo1-1
H2 (g) + O2 (g) =H2O (l); △H = -285.8kJ·mo1-1
⑴将2.4 g 炭转化为水煤气,再完全燃烧,整个过程的△H = kJ·mo1-1。
⑵最近有科学家提出“绿色自由”构想:把空气吹入碳酸钾溶液,然后再把CO2从溶液中
 提取出来,经化学反应后使之变为可再生燃料甲醇。“绿色自由”构想技术流程如下:
提取出来,经化学反应后使之变为可再生燃料甲醇。“绿色自由”构想技术流程如下:
在合成塔中,若有4.4kg CO2与足量H2恰好完全反应,可放出4947kJ的热量,试写出合成塔中发生反应的热化学方程式 。
⑶小亮同学拟用沉淀法测定空气中CO2的体积分数,他查得CaCO3、BaCO3的溶度积(Ksp)分别为4.96×10-9、2.58×10-9。小亮应该选用的试剂是 ,实验时测定的数据除空气的体积外,还需要测定 。
查看习题详情和答案>>(7 分 )水煤气 (主要成分:CO、H2 ) 是重要燃料和化工原料,可用水蒸气通过炽热的炭层制得:
C (s) + H2O(g)≒CO(g) +H2 (g);△H =+131.3kJ•mol-1
(1)某温度下,四个容器中均进行着上述反应,各容器中炭足量,其它物质的物质的量浓度及正逆反应速率关系如下表所示。请填写表中相应的空格。
| 容器编号 | c(H2O)/mol·L-1 | c(CO)/mol·L-1 | c(H2)/mol·L-1 | V正、V逆比较 |
| I | 0.06 | 0.60 | 0.10 | V正=V逆 |
| II | 0.06 | 0.50 | 0.40 | ? |
| III | 0.12 | 0.40 | 0.80 | V正<V逆 |
| IV | 0.12 | 0.30 | ? | V正=V逆 |
(2)另有一个容积可变的密闭容器。恒温恒压下,向其中加入1.0mol炭和 1.0mo l水蒸气(H216O),发生上述反应,达到平衡时,容器的体积变为原来的1.25倍。平衡时水蒸气的转化率为 ;向该容器中补充 a mol 炭,水蒸气的转化率将 (填 “增大”、“减小”、“不变”),再补充 a mol 水蒸气 (H218O), 最终容器中C16O和C18O 的物质的量之比为 。
(3)己知:C (s) + ![]() O2(g)=CO(g);△H = -110.5kJ·mo1-1
O2(g)=CO(g);△H = -110.5kJ·mo1-1
CO(g) + ![]() O2(g)=CO2 (g);△H =-283.0 kJ·mo1-1
O2(g)=CO2 (g);△H =-283.0 kJ·mo1-1
H2 (g) + ![]() O2(g) =H2O (g);△H = -241.8kJ·mo1-1
O2(g) =H2O (g);△H = -241.8kJ·mo1-1
那么,将2.4 g 炭完全转化为水煤气,然后再燃烧,整个过程△H = kJ·mo1-1
查看习题详情和答案>>