网址:http://m.1010jiajiao.com/timu_id_550374[举报]
题号
1
2
3
4
 5
5
6
7
8
9
答案
D
C
C
A
D
B
BC
C
B
题号
10
11
12
 13
13
14
15
16
17
18
答案
AD
C
A
B
B
B
A
D
B
19.(9分)
(1)A MnO2 浓盐酸 B 饱和食盐水 D NaOH溶液
(2)分液漏斗
(3)2NaBr+Cl2=2NaCl+Br2
(4)90%
20.(8分)
(1)B
(2)① 过氧化钠容易吸收空气中的H2O和CO2,不宜暴露在空气中称量,并且过氧化钠为粉末状不易全部转移到锥形瓶中。
(3)A 偏大
(4)
21.(6分)
(1)2Cl2+2Ca(OH)2 = CaCl2+Ca(ClO)2+2H2O
(2)Ca(ClO)2
(3)Ca(ClO)2 + CO2 + H2O == CaCO3↓+ 2 HClO
(4)碱性
 22.(8分)(1)B:Na2O2 E:NaHCO3;
22.(8分)(1)B:Na2O2 E:NaHCO3;
(2)2Na+2H2O=2NaOH+H2↑。
(3)CO2+2OH-=CO32-+H2O。
(4)2NaHCO3+2Na2O2 2Na2CO3+2NaOH+O2↑。
2Na2CO3+2NaOH+O2↑。
23.(11分)
(1)A.HCl(或浓HCl) C.Cl2 D.KBr G.KI
(2)C+D:Cl2+2KBr=2KCl+Br2 ;A+B:4HCl+MnO2 MnCl2+Cl2↑+2H2O;②;C
MnCl2+Cl2↑+2H2O;②;C
(3)5:1
24.(5分)(1)2Fe2++Cl2=2Fe3++2Cl-; (2)2x=3n; (3)x>;(4)1.5n。
25.(6分)(1)
26.(6分)(1)
利用Na2O2与水反应能放出氧气的性质,可通过选择装置A或B来测定已部分变质的Na2O2样品中Na2O2的质量分数。

(1)实验室提供的是500mL量筒,则实验中取用Na2O2样品的质量最合适的是_______。
A.0.1~0.2g B.2.5~3.0g C.5.0~6.0g D.10~15g
(2)如图托盘天平称取样品,应选用下图中的_________(填①或②)。不选用另一装置的原因是_______________。

(3)因Na2O2与水反应会放热而影响测定的准确性,所以反应结束后,必须使锥形瓶中的气体温度降低至室温,应选用装置A、B中的________(填A或B)。如果选用了另一种不适当的装置,测得的Na2O2的质量分数会________(填偏大或偏小),原因是___________。
(4)如在实验中,气体摩尔体积为a L?mol-1,量筒中收集到的水的体积为V mL,样品的质量为m g,则样品中Na2O2的质量分数为________________。
查看习题详情和答案>>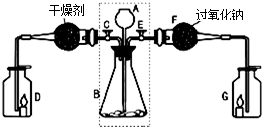
(1)关闭E打开C,从长颈漏斗A中加入液体与锥形瓶B中的固体接触,即有二氧化碳气体产生.观察到D中的蜡烛慢慢熄灭,说明二氧化碳具有
(2)关闭C打开E,观察到G中的蜡烛燃烧得更旺,说明有氧气生成.
[查阅资料]二氧化碳能与过氧化钠(Na2O2)反应生成碳酸钠和氧气.
[实验探究]要检验反应后F中的固体物质含有碳酸钠,可取少量反应后F中的固体物质于试管中,滴入
[实验结论]反应后F中的固体物质含有碳酸根离子.二氧化碳与过氧化钠反应的化学方程式为
[拓展联系]利用虚线框内装置还可以作为实验室制备
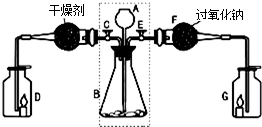
(1)关闭E打开C,从长颈漏斗A中加入液体与锥形瓶B中的固体接触,即有二氧化碳气体产生.观察到D中的蜡烛慢慢熄灭,说明二氧化碳具有______性质.写出实验室制取二氧化碳的化学方程式______.
(2)关闭C打开E,观察到G中的蜡烛燃烧得更旺,说明有氧气生成.
[查阅资料]二氧化碳能与过氧化钠(Na2O2)反应生成碳酸钠和氧气.
[实验探究]要检验反应后F中的固体物质含有碳酸钠,可取少量反应后F中的固体物质于试管中,滴入______,观察到有气泡产生;用蘸有澄清石灰水的玻璃片放在试管口,观察到______,写出该反应的化学方程式______.
[实验结论]反应后F中的固体物质含有碳酸根离子.二氧化碳与过氧化钠反应的化学方程式为______.
[拓展联系]利用虚线框内装置还可以作为实验室制备______的发生装置,写出反应的化学方程式______.
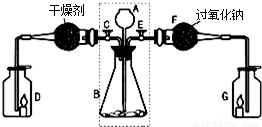
(1)关闭E打开C,从长颈漏斗A中加入液体与锥形瓶B中的固体接触,即有二氧化碳气体产生.观察到D中的蜡烛慢慢熄灭,说明二氧化碳具有______性质.写出实验室制取二氧化碳的化学方程式______.
(2)关闭C打开E,观察到G中的蜡烛燃烧得更旺,说明有氧气生成.
[查阅资料]二氧化碳能与过氧化钠(Na2O2)反应生成碳酸钠和氧气.
[实验探究]要检验反应后F中的固体物质含有碳酸钠,可取少量反应后F中的固体物质于试管中,滴入______,观察到有气泡产生;用蘸有澄清石灰水的玻璃片放在试管口,观察到______,写出该反应的化学方程式______.
[实验结论]反应后F中的固体物质含有碳酸根离子.二氧化碳与过氧化钠反应的化学方程式为______.
[拓展联系]利用虚线框内装置还可以作为实验室制备______的发生装置,写出反应的化学方程式______.
查看习题详情和答案>>
(1)CO2是一种重要的物质,但其过量排放,可能导致全球气温升高.下列措施不能够有效控制CO2所导致的温室效应的是
①大力发展低碳产业,提倡低碳生活,依法控制CO2的过量排放
②禁止滥砍滥伐,植树造林,恢复生态
③开发利用各种新型能源代替煤、石油、天然气等化石能源
④提倡使用脱硫煤、无铅汽油等清洁燃料
(2)常温下,碳酸在水中的电离常数Ka1=4.2×10-7,Ka2=5.6×10-11;次氯酸在水中的电离常数Ka=4.7×10-8.写出84消毒液露置在空气中发生反应的离子方程式
(3)CO具有还原性,某同学设计图示装置(固定装置及胶管略去)验证CO气体能否与Na2O2反应.
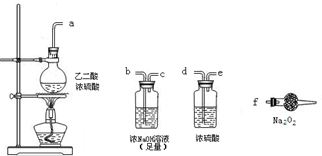
已知:H2C2O4
| ||
| △ |
(4)已知C(s)+O2(g)=CO2(g),△H=-393.5kJ?mol-1;CO(g)+
| 1 |
| 2 |