摘要:分析判断盐溶液酸碱性时要考虑水解.
网址:http://m.1010jiajiao.com/timu_id_540250[举报]
氯气是一种重要的化工原料.某学习小组在实验室中利用如图所示装置制取氯气并探究其性质.
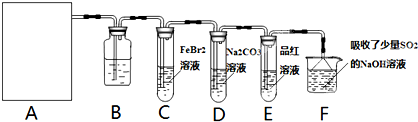
(1)若A是用二氧化锰和浓盐酸反应制取氯气的发生装置,除圆底烧瓶和导管外还用到的玻璃仪器有______;
(2)①装置B中盛有的试剂是______,作用是______.
②若E中品红溶液褪色,则C装置中发生反应的离子方程式是______.证明FeBr2与Cl2发生了氧化还原反应的实验方法是______(填操作方法).
③已知碳酸的酸性强于次氯酸,则装置D中反应的化学方程式为______.
(3)某研究性学习小组用刚吸收过少量SO2的NaOH溶液吸收处理上述实验后的尾气.吸收尾气一段时间后,吸收液(呈强碱性)中肯定存在Cl-、OH-、CO32-和SO42-.请设计实验,探究该吸收液中可能存在的其他阴离子(不考虑盐类的水解;在碱性条件下ClO-也有强氧化性.).
①提出合理假设:
假设1:只存在SO32-;
假设2:只存在ClO-;
假设3:既存在SO32-,也存在ClO-;
假设4:既不存在SO32-,也不存在ClO-.
指导老师经分析认为,其中一个假设并不合理,它是______;判断的原因是______.
②设计实验方案,进行实验,请写出实验步骤以及预期现象和结论.限选实验试剂.
a.3mol/L H2SO4 b.0.01mol/L KMnO4 c.1mol/L BaCl2溶液
d.淀粉一KI溶液 e.酚酞试液 f.品红溶液
步骤一;取少量吸收液于试管中,滴加3mol/L H2SO4至溶液呈酸性,然后将所得溶液分装于A、B两试管中.
步骤二:向A试管中滴加1~2滴______ (填序号).若溶液______(填现象),则假设1成立.
步骤三:向B试管中滴加1~2滴______(填序号);若溶液______(填现象),则假设2成立.
③若假设2成立;写出步骤三中的离子方程式:______.
查看习题详情和答案>>
氯气是一种重要的化工原料.某学习小组在实验室中利用如图所示装置制取氯气并探究其性质.
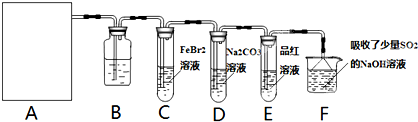
(1)若A是用二氧化锰和浓盐酸反应制取氯气的发生装置,除圆底烧瓶和导管外还用到的玻璃仪器有______;
(2)①装置B中盛有的试剂是______,作用是______.
②若E中品红溶液褪色,则C装置中发生反应的离子方程式是______.证明FeBr2与Cl2发生了氧化还原反应的实验方法是______(填操作方法).
③已知碳酸的酸性强于次氯酸,则装置D中反应的化学方程式为______.
(3)某研究性学习小组用刚吸收过少量SO2的NaOH溶液吸收处理上述实验后的尾气.吸收尾气一段时间后,吸收液(呈强碱性)中肯定存在Cl-、OH-、CO32-和SO42-.请设计实验,探究该吸收液中可能存在的其他阴离子(不考虑盐类的水解;在碱性条件下ClO-也有强氧化性.).
①提出合理假设:
假设1:只存在SO32-;
假设2:只存在ClO-;
假设3:既存在SO32-,也存在ClO-;
假设4:既不存在SO32-,也不存在ClO-.
指导老师经分析认为,其中一个假设并不合理,它是______;判断的原因是______.
②设计实验方案,进行实验,请写出实验步骤以及预期现象和结论.限选实验试剂.
a.3mol/L H2SO4 b.0.01mol/L KMnO4 c.1mol/L BaCl2溶液
d.淀粉一KI溶液 e.酚酞试液 f.品红溶液
步骤一;取少量吸收液于试管中,滴加3mol/L H2SO4至溶液呈酸性,然后将所得溶液分装于A、B两试管中.
步骤二:向A试管中滴加1~2滴______ (填序号).若溶液______(填现象),则假设1成立.
步骤三:向B试管中滴加1~2滴______(填序号);若溶液______(填现象),则假设2成立.
③若假设2成立;写出步骤三中的离子方程式:______.
查看习题详情和答案>>

(1)若A是用二氧化锰和浓盐酸反应制取氯气的发生装置,除圆底烧瓶和导管外还用到的玻璃仪器有______;
(2)①装置B中盛有的试剂是______,作用是______.
②若E中品红溶液褪色,则C装置中发生反应的离子方程式是______.证明FeBr2与Cl2发生了氧化还原反应的实验方法是______(填操作方法).
③已知碳酸的酸性强于次氯酸,则装置D中反应的化学方程式为______.
(3)某研究性学习小组用刚吸收过少量SO2的NaOH溶液吸收处理上述实验后的尾气.吸收尾气一段时间后,吸收液(呈强碱性)中肯定存在Cl-、OH-、CO32-和SO42-.请设计实验,探究该吸收液中可能存在的其他阴离子(不考虑盐类的水解;在碱性条件下ClO-也有强氧化性.).
①提出合理假设:
假设1:只存在SO32-;
假设2:只存在ClO-;
假设3:既存在SO32-,也存在ClO-;
假设4:既不存在SO32-,也不存在ClO-.
指导老师经分析认为,其中一个假设并不合理,它是______;判断的原因是______.
②设计实验方案,进行实验,请写出实验步骤以及预期现象和结论.限选实验试剂.
a.3mol/L H2SO4 b.0.01mol/L KMnO4 c.1mol/L BaCl2溶液
d.淀粉一KI溶液 e.酚酞试液 f.品红溶液
步骤一;取少量吸收液于试管中,滴加3mol/L H2SO4至溶液呈酸性,然后将所得溶液分装于A、B两试管中.
步骤二:向A试管中滴加1~2滴______ (填序号).若溶液______(填现象),则假设1成立.
步骤三:向B试管中滴加1~2滴______(填序号);若溶液______(填现象),则假设2成立.
③若假设2成立;写出步骤三中的离子方程式:______.
氯气是一种重要的化工原料.某学习小组在实验室中利用如图所示装置制取氯气并探究其性质.
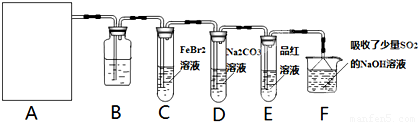
(1)若A是用二氧化锰和浓盐酸反应制取氯气的发生装置,除圆底烧瓶和导管外还用到的玻璃仪器有______;
(2)①装置B中盛有的试剂是______,作用是______.
②若E中品红溶液褪色,则C装置中发生反应的离子方程式是______.证明FeBr2与Cl2发生了氧化还原反应的实验方法是______(填操作方法).
③已知碳酸的酸性强于次氯酸,则装置D中反应的化学方程式为______.
(3)某研究性学习小组用刚吸收过少量SO2的NaOH溶液吸收处理上述实验后的尾气.吸收尾气一段时间后,吸收液(呈强碱性)中肯定存在Cl-、OH-、CO32-和SO42-.请设计实验,探究该吸收液中可能存在的其他阴离子(不考虑盐类的水解;在碱性条件下ClO-也有强氧化性.).
①提出合理假设:
假设1:只存在SO32-;
假设2:只存在ClO-;
假设3:既存在SO32-,也存在ClO-;
假设4:既不存在SO32-,也不存在ClO-.
指导老师经分析认为,其中一个假设并不合理,它是______;判断的原因是______.
②设计实验方案,进行实验,请写出实验步骤以及预期现象和结论.限选实验试剂.
a.3mol/L H2SO4 b.0.01mol/L KMnO4 c.1mol/L BaCl2溶液
d.淀粉一KI溶液 e.酚酞试液 f.品红溶液
步骤一;取少量吸收液于试管中,滴加3mol/L H2SO4至溶液呈酸性,然后将所得溶液分装于A、B两试管中.
步骤二:向A试管中滴加1~2滴______ (填序号).若溶液______(填现象),则假设1成立.
步骤三:向B试管中滴加1~2滴______(填序号);若溶液______(填现象),则假设2成立.
③若假设2成立;写出步骤三中的离子方程式:______.
查看习题详情和答案>>

(1)若A是用二氧化锰和浓盐酸反应制取氯气的发生装置,除圆底烧瓶和导管外还用到的玻璃仪器有______;
(2)①装置B中盛有的试剂是______,作用是______.
②若E中品红溶液褪色,则C装置中发生反应的离子方程式是______.证明FeBr2与Cl2发生了氧化还原反应的实验方法是______(填操作方法).
③已知碳酸的酸性强于次氯酸,则装置D中反应的化学方程式为______.
(3)某研究性学习小组用刚吸收过少量SO2的NaOH溶液吸收处理上述实验后的尾气.吸收尾气一段时间后,吸收液(呈强碱性)中肯定存在Cl-、OH-、CO32-和SO42-.请设计实验,探究该吸收液中可能存在的其他阴离子(不考虑盐类的水解;在碱性条件下ClO-也有强氧化性.).
①提出合理假设:
假设1:只存在SO32-;
假设2:只存在ClO-;
假设3:既存在SO32-,也存在ClO-;
假设4:既不存在SO32-,也不存在ClO-.
指导老师经分析认为,其中一个假设并不合理,它是______;判断的原因是______.
②设计实验方案,进行实验,请写出实验步骤以及预期现象和结论.限选实验试剂.
a.3mol/L H2SO4 b.0.01mol/L KMnO4 c.1mol/L BaCl2溶液
d.淀粉一KI溶液 e.酚酞试液 f.品红溶液
步骤一;取少量吸收液于试管中,滴加3mol/L H2SO4至溶液呈酸性,然后将所得溶液分装于A、B两试管中.
步骤二:向A试管中滴加1~2滴______ (填序号).若溶液______(填现象),则假设1成立.
步骤三:向B试管中滴加1~2滴______(填序号);若溶液______(填现象),则假设2成立.
③若假设2成立;写出步骤三中的离子方程式:______.
查看习题详情和答案>>
氯气是一种重要的化工原料.某学习小组在实验室中利用如图所示装置制取氯气并探究其性质.
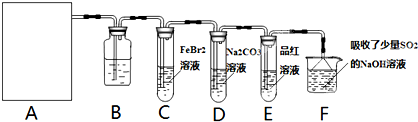
(1)若A是用二氧化锰和浓盐酸反应制取氯气的发生装置,除圆底烧瓶和导管外还用到的玻璃仪器有
(2)①装置B中盛有的试剂是
②若E中品红溶液褪色,则C装置中发生反应的离子方程式是
③已知碳酸的酸性强于次氯酸,则装置D中反应的化学方程式为
(3)某研究性学习小组用刚吸收过少量SO2的NaOH溶液吸收处理上述实验后的尾气.吸收尾气一段时间后,吸收液(呈强碱性)中肯定存在Cl-、OH-、CO32-和SO42-.请设计实验,探究该吸收液中可能存在的其他阴离子(不考虑盐类的水解;在碱性条件下ClO-也有强氧化性.).
①提出合理假设:
假设1:只存在SO32-;
假设2:只存在ClO-;
假设3:既存在SO32-,也存在ClO-;
假设4:既不存在SO32-,也不存在ClO-.
指导老师经分析认为,其中一个假设并不合理,它是
②设计实验方案,进行实验,请写出实验步骤以及预期现象和结论.限选实验试剂.
a.3mol/L H2SO4 b.0.01mol/L KMnO4 c.1mol/L BaCl2溶液
d.淀粉一KI溶液 e.酚酞试液 f.品红溶液
步骤一;取少量吸收液于试管中,滴加3mol/L H2SO4至溶液呈酸性,然后将所得溶液分装于A、B两试管中.
步骤二:向A试管中滴加1~2滴
步骤三:向B试管中滴加1~2滴
③若假设2成立;写出步骤三中的离子方程式:
查看习题详情和答案>>

(1)若A是用二氧化锰和浓盐酸反应制取氯气的发生装置,除圆底烧瓶和导管外还用到的玻璃仪器有
分液漏斗、酒精灯
分液漏斗、酒精灯
;(2)①装置B中盛有的试剂是
饱和食盐水
饱和食盐水
,作用是除去氯气中的氯化氢杂质
除去氯气中的氯化氢杂质
.②若E中品红溶液褪色,则C装置中发生反应的离子方程式是
2Fe2++4Br-+3Cl2═2Fe3++6Cl-+2Br2
2Fe2++4Br-+3Cl2═2Fe3++6Cl-+2Br2
.证明FeBr2与Cl2发生了氧化还原反应的实验方法是实验后取下装置C的橡胶塞,取少量C中溶液于试管中,滴加KSCN溶液
实验后取下装置C的橡胶塞,取少量C中溶液于试管中,滴加KSCN溶液
(填操作方法).③已知碳酸的酸性强于次氯酸,则装置D中反应的化学方程式为
2Cl2+Na2CO3 +H2O=CO2+2NaCl+2HClO
2Cl2+Na2CO3 +H2O=CO2+2NaCl+2HClO
.(3)某研究性学习小组用刚吸收过少量SO2的NaOH溶液吸收处理上述实验后的尾气.吸收尾气一段时间后,吸收液(呈强碱性)中肯定存在Cl-、OH-、CO32-和SO42-.请设计实验,探究该吸收液中可能存在的其他阴离子(不考虑盐类的水解;在碱性条件下ClO-也有强氧化性.).
①提出合理假设:
假设1:只存在SO32-;
假设2:只存在ClO-;
假设3:既存在SO32-,也存在ClO-;
假设4:既不存在SO32-,也不存在ClO-.
指导老师经分析认为,其中一个假设并不合理,它是
假设3
假设3
;判断的原因是ClO-与SO32-因发生氧化还原反应而不能大量共存
ClO-与SO32-因发生氧化还原反应而不能大量共存
.②设计实验方案,进行实验,请写出实验步骤以及预期现象和结论.限选实验试剂.
a.3mol/L H2SO4 b.0.01mol/L KMnO4 c.1mol/L BaCl2溶液
d.淀粉一KI溶液 e.酚酞试液 f.品红溶液
步骤一;取少量吸收液于试管中,滴加3mol/L H2SO4至溶液呈酸性,然后将所得溶液分装于A、B两试管中.
步骤二:向A试管中滴加1~2滴
b
b
(填序号).若溶液褪色
褪色
(填现象),则假设1成立.步骤三:向B试管中滴加1~2滴
d
d
(填序号);若溶液变蓝色
变蓝色
(填现象),则假设2成立.③若假设2成立;写出步骤三中的离子方程式:
2I-+ClO-+2H+═I2+H2O+Cl-
2I-+ClO-+2H+═I2+H2O+Cl-
.硫酸亚铁铵的化学式为(NH4)2Fe(SO4)2?6H2O,商品名为摩尔盐.硫酸亚铁可与硫酸铵生成硫酸亚铁铵,一般硫酸亚铁盐在空气中易被氧化,而形成摩尔盐后就比较稳定了.三种盐的溶解度(单位为g/100g水)如下表
实验室欲制备硫酸亚铁铵晶体,设计了如下方案.
(1)完成实验步骤中的填空:
①称取4g铁屑,放入小烧杯,加入15mL10%Na2CO3溶液,小火加热10min以除去
②将处理好的铁屑放入小烧杯,加入15mL 3mol/L H2SO4溶液,水浴加热至不再有气体生成为止,趁热过滤去剩余铁屑,并用少量热水洗涤烧杯及滤纸,并将滤液和洗涤液一起转移到蒸发皿中,则蒸发皿中溶液的溶质为
③加入
(2)回答下列问题:
①硫酸亚铁溶液在空气中易被氧化变质,操作时应注意:a
②加热、浓缩溶液时,不浓缩至干的理由是
③硫酸亚铁和硫酸铵的混合溶液加热浓缩就能得到硫酸亚铁铵晶体,其原因是
④称取两份质量均为1.96g的该硫酸亚铁铵,制成溶液.用未知浓度的KMnO4酸性溶液进行滴定.
Ⅰ) 滴定时,将KMnO4酸性溶液装在
Ⅱ) 已知MnO4-被还原为Mn2+,试写出该滴定过程中的离子方程式:
Ⅲ) 判断该反应到达滴定终点的现象为
Ⅳ) 假设到达滴定终点时,用去V mL KMnO4酸性溶液,则该KMnO4酸性溶液的浓度为
mol/L.
查看习题详情和答案>>
| 温度/℃ | 10 | 20 | 30 | 40 | 50 | 70 |
| (NH4)2SO4 | 73.0 | 75.4 | 78.0 | 81.0 | 84.5 | 91.9 |
| FeSO4?7H2O | 40.0 | 48.0 | 60.0 | 73.3 | - | - |
| (NH4)2Fe(SO4)2?6H2O | 18.1 | 21.2 | 24.5 | 27.9 | 31.3 | 38.5 |
(1)完成实验步骤中的填空:
①称取4g铁屑,放入小烧杯,加入15mL10%Na2CO3溶液,小火加热10min以除去
铁屑表面的油污
铁屑表面的油污
,倒掉溶液,用蒸馏水把铁冲洗干净,干燥,备用;②将处理好的铁屑放入小烧杯,加入15mL 3mol/L H2SO4溶液,水浴加热至不再有气体生成为止,趁热过滤去剩余铁屑,并用少量热水洗涤烧杯及滤纸,并将滤液和洗涤液一起转移到蒸发皿中,则蒸发皿中溶液的溶质为
硫酸亚铁
硫酸亚铁
(填名称,不考虑水解),其物质的量约为0.045
0.045
mol;③加入
5.94
5.94
g硫酸铵到蒸发皿中,缓缓加热、浓缩至表面出现结晶膜为止、冷却,得硫酸亚铁铵晶体.(2)回答下列问题:
①硫酸亚铁溶液在空气中易被氧化变质,操作时应注意:a
过滤洗涤操作速度要快
过滤洗涤操作速度要快
;b步骤③要缓缓加热,避免沸腾
步骤③要缓缓加热,避免沸腾
;②加热、浓缩溶液时,不浓缩至干的理由是
因为析出的是硫酸亚铁铵晶体,带有结晶水,蒸干会使晶体分解
因为析出的是硫酸亚铁铵晶体,带有结晶水,蒸干会使晶体分解
;③硫酸亚铁和硫酸铵的混合溶液加热浓缩就能得到硫酸亚铁铵晶体,其原因是
因为相同温度下硫酸亚铁铵晶体在水中的溶解度比硫酸亚铁和硫酸铵的溶解度小
因为相同温度下硫酸亚铁铵晶体在水中的溶解度比硫酸亚铁和硫酸铵的溶解度小
;④称取两份质量均为1.96g的该硫酸亚铁铵,制成溶液.用未知浓度的KMnO4酸性溶液进行滴定.
Ⅰ) 滴定时,将KMnO4酸性溶液装在
酸式
酸式
(酸式或碱式)滴定管,操作时用右
右
手拿锥形瓶;Ⅱ) 已知MnO4-被还原为Mn2+,试写出该滴定过程中的离子方程式:
5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O
5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O
;Ⅲ) 判断该反应到达滴定终点的现象为
当滴加最后一滴溶液后,溶液变成紫红色,30S内不褪色,说明达到滴定终点
当滴加最后一滴溶液后,溶液变成紫红色,30S内不褪色,说明达到滴定终点
;Ⅳ) 假设到达滴定终点时,用去V mL KMnO4酸性溶液,则该KMnO4酸性溶液的浓度为
| 1 |
| V |
| 1 |
| V |