网址:http://m.1010jiajiao.com/timu_id_539864[举报]
一.选择题:
题号
1
2
3
4
5
6
7
8
9
10
11
答案
D
B
B
C
B
C
A
D
B
B
C
题号
12
13
14
15
16
17
18
19
20
21
答案
D
B
A
BD
AC
ABC
D
D
AD
BD
22.(共18分)
(1)CD(4分)

23.(16分)解:
⑴ (3分)
(3分)
 (3分)
(3分)
⑵ (4分)
(4分)
 (1分)
(1分)
 (5分)
(5分)
24.(18分)解:
(1) (2分)
(2分)
 (2分)
(2分)
 (2分)
(2分)
射出电场后做匀速直线运动,则在磁场中的速度为2.5×
(2)与速度x轴的夹角
经过电场的偏距 (2分)
(2分)
故有 (2分)
(2分)
(3)作出粒子在磁场中的运动轨迹,如图
则 (3分)
(3分)
因为
解得 (2分)
(2分)
 根据
根据 (3分)
(3分)
25.(20分)解:
(1)前4 s内,金属杆切割磁感线产生的感应电动势为 ①(1分)
①(1分)
由闭合电路欧姆定律可知A的示数 ②(1分)
②(1分)
而由图乙可知 ③(1分)
③(1分)
由②③式得 ④(1分)
④(1分)
由④式可知。随v时间t均匀增大,所以金属杆做匀加速直线运动其中加速度a=
(2)同理,后2 s内
由图乙可知 (其中k‘=
(其中k‘=
由②⑤式得 ⑥(1分)
⑥(1分)
由⑥式可知v‘随时间t‘均匀减小,所以金属杆做匀减速直线运动
其中加速度 (1分)
(1分)
t=5s(即t‘=1s)时,由⑤式得I‘=
安培力 (1分)
(1分)
再由牛顿第二定律有 ⑦(1分)
⑦(1分)
 故
故 (1分)
(1分)
所以F的瞬时功率为P=Fv‘=0.6 W (1分)
(3)前4 s内,由牛顿第二定律有
 (1分)
(1分)
 ⑧(1分)
⑧(1分)
图线为直线, 时,F1=0.55 N,t=4 s时,F2=0.95 N
时,F1=0.55 N,t=4 s时,F2=0.95 N
(1分)
后2 s内,由牛顿第二定律有 (1分)
(1分)
 ⑨(1分)
⑨(1分)
图线为直线, (即t=4 s)时,
(即t=4 s)时, (即t=6 s)时,
(即t=6 s)时, (1分)
(1分)
根据以上分析,作出 图象 见答图 (2分)
图象 见答图 (2分)
26.(14分)(2分×7)
(1)Cu(NO3)2 + 2H2O
 Cu(OH)2
+ 2HNO3
Cu(OH)2
+ 2HNO3
(2)剧烈燃烧,放出大量的热,发出耀眼的白光。
(3)① ③
(4)② 3Fe2+ + NO3-+ 4H+ = 3Fe3+ + NO↑+ 2H2O
④
(5)2Na2O2 + 2Cu(NO3)2 + 2H2O = 2Cu(OH)2+ 4NaNO3 + O2↑
(6)
27. (14分)
(1) B(1分) A (1分) C (1分)
CaCO3 + 2H+ = Ca2+ + CO2↑ + H2O (2分)
(2) ① 2Na + 2CO2  CO
+ Na2CO3 (3分)
CO
+ Na2CO3 (3分)
② 4Na + 3CO2
 2Na2CO3
+ C (3分)
2Na2CO3
+ C (3分)
(3) 将残留物溶于适量水,若有黑色不溶物则证明残留物中有C,在溶液中加足量BaCl2溶液,然后过滤,在滤液中滴加几滴酚酞,若溶液变红,则证明残留物中含有Na2O。 (3分)
28. (16分) (2分×8)
Ⅰ.
A:  或
或  或 C6H5COOCH3
或 C6H5COOCH3
B: 
 或C6H5CH2OCHO
或C6H5CH2OCHO
C: 或
或  或C6H5OCOCH3
或C6H5OCOCH3
D:  或
或  或C6H5CH2COOH
或C6H5CH2COOH
Ⅱ.(1)Br2 NaOH H2O
(2)HOCH2CH2OCH2CH2OCH2CH2OH 40?
(3)
29.(16分)(2分×8)
Ⅰ.(1) 4 5×10-5mol/L (2) 4 1×10-4mol/L
Ⅱ.(1) (2) ① 减小 升温(或通入A气体) ② 任意值 (或C≥0)
(2) ① 减小 升温(或通入A气体) ② 任意值 (或C≥0)
30.(26分)(1)肝 必需氨基酸 (2)a 促甲状腺激素释放激素 肾上腺素 ①②
(3)①电刺激交感神经后引起肾上腺髓质产生的某种物质通过血液循环运送到心脏,促进心跳加快。
②第二步:电刺激甲鼠支配肾上腺髓质的交感神经,立即用等渗溶液提取甲鼠肾上腺髓质组织液。
第三步:将提取液注射到乙鼠体内。一段时间后测定乙鼠的心率并记录。
Ⅱ.(1)A DEF 。 m/125 千焦 。D增多,F减少 。
(2) 兔→狼 草 兔

 2CA3(g)
2CA3(g)  7N2(g)+12H2O(g)也可处理NO2。则化学平衡常数表达式K=______;当转移1.2mol电子时,消耗的NO2在标准状况下是_______L。
7N2(g)+12H2O(g)也可处理NO2。则化学平衡常数表达式K=______;当转移1.2mol电子时,消耗的NO2在标准状况下是_______L。 
 CO2+H2(g) 反应过程中测定的部分数据见下表(表中t1>t2)
CO2+H2(g) 反应过程中测定的部分数据见下表(表中t1>t2) 


 2SO3(g)。反应体系中SO3的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题:
2SO3(g)。反应体系中SO3的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题:
 0(填“>’或“<”)。
0(填“>’或“<”)。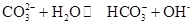 ,25℃时该反应的K=2×10-4mol·L-1,则当溶液中c(HCO- 3):c(CO2- 3)=2∶1时,溶液的pH= 。
,25℃时该反应的K=2×10-4mol·L-1,则当溶液中c(HCO- 3):c(CO2- 3)=2∶1时,溶液的pH= 。