摘要:(1)如图是干电池的基本构造图.干电池工作时正极上的反应是则负极上的电极反应式是 .MnO2的作用是除去正极上的某产物.本身生成Mn2O3.该反应的化学方程式是 .(2)锌皮和碳棒的回收:用钳子和剪子剪开回收的干电池的锌筒.将锌皮和碳棒取出.刷洗干净.将电池内的黑色粉末移入小烧杯中.
网址:http://m.1010jiajiao.com/timu_id_516106[举报]
 锌锰干电池是最早使用的化学电池,其基本构造如图所示.
锌锰干电池是最早使用的化学电池,其基本构造如图所示.(1)锌锰干电池的负极是
Zn
Zn
,电路中每通过0.2mole-,负极质量减少6.5
6.5
g;工作时NH4+离子在正极放电产生两种气体,其中一种气体分子是含10e-的微粒,正极的电极反应式是2NH4++2e-=2NH3↑+H2↑
2NH4++2e-=2NH3↑+H2↑
.(2)某研究小组对电池内黑色糊状物进行了下列实验.
电池内黑色糊状物粉末
无色溶液
溶解过滤
黑色残渣
已知:Zn(OH)2是两性氢氧化物.完成下列实验报告.
| 实验步骤 | 实验现象 | 实验结论和解释 | ||||||||
| 取少量上述无色溶液于试 管中,逐滴加入NaOH溶液,直至过量,再加热 | 生成白色沉淀, 白色沉淀消失, 白色沉淀消失, 产生有刺激性气味的气体 产生有刺激性气味的气体 |
无色溶液中存在Zn2+、NH4+离子 检验NH4+离子存在的离子方程式是 NH4++OH-
NH4++OH-
|

| 序号 | 烧瓶中的物质 | 实验记录 | 实验结论与解释 |
| 实验一 | 足量MnO2 | 收集到56mL气体 | MnO2做催化剂 |
| 实验二 | 足量MnO2和稀硫酸 | 黑色粉末部分溶解, 收集到112mL气体 |
MnO2做氧化剂,生成Mn2+离子 |
1:1
1:1
,实验二中反应的离子方程式为H2O2+2H++MnO2=Mn2++2H2O+O2↑
H2O2+2H++MnO2=Mn2++2H2O+O2↑
.锌锰干电池是最早使用的化学电池,其基本构造如图所示.
(1)锌锰干电池的负极是______,电路中每通过0.2mole-,负极质量减少______g;工作时NH4+离子在正极放电产生两种气体,其中一种气体分子是含10e-的微粒,正极的电极反应式是______.
(2)某研究小组对电池内黑色糊状物进行了下列实验.
电池内黑色糊状物粉末
无色溶液
溶解过滤
黑色残渣
已知:Zn(OH)2是两性氢氧化物.完成下列实验报告.
(3)利用残渣中分离出的MnO2,研究其在H2O2制O2过程中的作用.实验装置如右图所示.将等物质的量浓度、等体积H2O2溶液加入烧瓶中,分别进行2个实验(气体的体积在相同条件下测定).
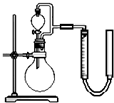
实验一、二中参加反应的H2O2的物质的量之比为______,实验二中反应的离子方程式为______.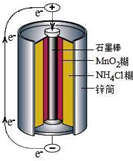
查看习题详情和答案>>
(1)锌锰干电池的负极是______,电路中每通过0.2mole-,负极质量减少______g;工作时NH4+离子在正极放电产生两种气体,其中一种气体分子是含10e-的微粒,正极的电极反应式是______.
(2)某研究小组对电池内黑色糊状物进行了下列实验.
电池内黑色糊状物粉末
无色溶液
溶解过滤
黑色残渣
已知:Zn(OH)2是两性氢氧化物.完成下列实验报告.
| 实验步骤 | 实验现象 | 实验结论和解释 |
| 取少量上述无色溶液于试 管中,逐滴加入NaOH溶液,直至过量,再加热 | 生成白色沉淀, ______ ______ |
无色溶液中存在Zn2+、NH4+离子 检验NH4+离子存在的离子方程式是 ______ |

| 序号 | 烧瓶中的物质 | 实验记录 | 实验结论与解释 |
| 实验一 | 足量MnO2 | 收集到56mL气体 | MnO2做催化剂 |
| 实验二 | 足量MnO2和稀硫酸 | 黑色粉末部分溶解, 收集到112mL气体 |
MnO2做氧化剂,生成Mn2+离子 |

锌锰干电池是最早使用的化学电池,其基本构造如图所示.
(1)锌锰干电池的负极是______,电路中每通过0.2mole-,负极质量减少______g;工作时NH4+离子在正极放电产生两种气体,其中一种气体分子是含10e-的微粒,正极的电极反应式是______.
(2)某研究小组对电池内黑色糊状物进行了下列实验.
电池内黑色糊状物粉末
无色溶液
溶解过滤
黑色残渣
已知:Zn(OH)2是两性氢氧化物.完成下列实验报告.
NH3↑+H2O
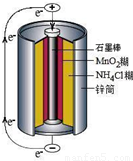 查看习题详情和答案>>
查看习题详情和答案>>
(1)锌锰干电池的负极是______,电路中每通过0.2mole-,负极质量减少______g;工作时NH4+离子在正极放电产生两种气体,其中一种气体分子是含10e-的微粒,正极的电极反应式是______.
(2)某研究小组对电池内黑色糊状物进行了下列实验.
电池内黑色糊状物粉末
无色溶液
溶解过滤
黑色残渣
已知:Zn(OH)2是两性氢氧化物.完成下列实验报告.
| 实验步骤 | 实验现象 | 实验结论和解释 |
| 取少量上述无色溶液于试 管中,逐滴加入NaOH溶液,直至过量,再加热 | 生成白色沉淀, ______ ______ | 无色溶液中存在Zn2+、NH4+离子 检验NH4+离子存在的离子方程式是 ______ |
 查看习题详情和答案>>
查看习题详情和答案>>
锌锰干电池是最早使用的化学电池,其基本构造如图所示.
(1)锌锰干电池的负极是______,电路中每通过0.2mole-,负极质量减少______g;工作时NH4+离子在正极放电产生两种气体,其中一种气体分子是含10e-的微粒,正极的电极反应式是______.
(2)某研究小组对电池内黑色糊状物进行了下列实验.
电池内黑色糊状物粉末
无色溶液
溶解过滤
黑色残渣
已知:Zn(OH)2是两性氢氧化物.完成下列实验报告.
NH3↑+H2O
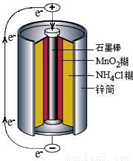 查看习题详情和答案>>
查看习题详情和答案>>
(1)锌锰干电池的负极是______,电路中每通过0.2mole-,负极质量减少______g;工作时NH4+离子在正极放电产生两种气体,其中一种气体分子是含10e-的微粒,正极的电极反应式是______.
(2)某研究小组对电池内黑色糊状物进行了下列实验.
电池内黑色糊状物粉末
无色溶液
溶解过滤
黑色残渣
已知:Zn(OH)2是两性氢氧化物.完成下列实验报告.
| 实验步骤 | 实验现象 | 实验结论和解释 |
| 取少量上述无色溶液于试 管中,逐滴加入NaOH溶液,直至过量,再加热 | 生成白色沉淀, ______ ______ | 无色溶液中存在Zn2+、NH4+离子 检验NH4+离子存在的离子方程式是 ______ |
 查看习题详情和答案>>
查看习题详情和答案>>
锌锰干电池是最早使用的化学电池,其基本构造如图1所示.
(1)锌锰干电池的负极电极反应式是______,电路中每通过0.4mole-,负极质量减少______g;工作时NH4+离子在正极放电产生2种气体,其中一种气体分子是含10e-的微粒,正极的电极反应式是______.
(2)某研究小组对电池内黑色糊状物进行了如图2所示实验
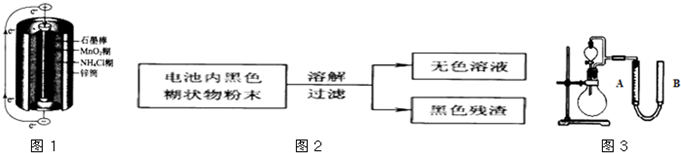
已知:Zn(OH)2是两性氢氧化物.完成下列实验报告:
(3)利用残渣中分离出的MnO2,研究其在H2O2制O2过程中的作用.实验装置如图3所示.将等物质的量浓度、等体积H2O2溶液加入分液漏斗中,分别进行2个实验(气体的体积在相同条件下测定).
①实验一、二中参加反应的H2O2的物质的量之比为______;
②实验二中反应的离子方程式为______;
③在测量气体体积时,除要注意待气体温度恢复至室温、平视读数外,还需要注意______.
查看习题详情和答案>>
(1)锌锰干电池的负极电极反应式是______,电路中每通过0.4mole-,负极质量减少______g;工作时NH4+离子在正极放电产生2种气体,其中一种气体分子是含10e-的微粒,正极的电极反应式是______.
(2)某研究小组对电池内黑色糊状物进行了如图2所示实验

已知:Zn(OH)2是两性氢氧化物.完成下列实验报告:
| 实验步骤 | 实验现象 | 实验结论 |
| ①取少量上述无色溶液于试管中,逐滴加入NaOH溶液,直至过量. | 生成白色沉淀,______ | 无色溶液中 存在Zn2+离子 |
| ②______ | ______ | 无色溶液中 存在NH4+离子 |
| 序号 | 烧瓶中的物质 | 实验记录 | 实验结论与解释 |
| 实验一 | 足量MnO2 | 收集到56mL气体 | MnO2做催化剂 |
| 实验二 | 足量MnO2 和稀硫酸 | 黑色粉末部分溶解, 收集到112mL气体 | ______ ______ |
②实验二中反应的离子方程式为______;
③在测量气体体积时,除要注意待气体温度恢复至室温、平视读数外,还需要注意______.