网址:http://m.1010jiajiao.com/timu_id_515323[举报]
第I卷(共126分)
一、选择题(78分)
1.B 2.C 3.D 4.A 5.D 6.B 7.C 8.A 9.D 10.B 11.D
12.A 13.C
二、选择题(48分)
14.A 15.C 16.D 17.C 18.BD 19.CD 20.B 21.AC
第Ⅱ卷(共174分)
.files/image271.jpg) 22.(17分)
22.(17分)
(1)①BCD全对得2分,对而不全得1分,有错不得分。
②.files/image273.gif) 3分
3分
(2)①如图1所示 2分
②B E D 每空2分, 共6分
③.files/image275.gif) 2分
2分 .files/image277.gif) 2分
2分
23.(16分)解:(1)设两人奔跑的最大速度为.files/image279.gif) ,乙在接力区跑出的距离为
,乙在接力区跑出的距离为.files/image281.gif) 时速度达到
时速度达到.files/image283.gif) ,根据运动学公式有
,根据运动学公式有.files/image285.gif) 2分
2分
.files/image287.gif) 2分
2分
解得.files/image289.gif) 3分
3分
(2)设乙在距甲.files/image291.gif) 处开始起跑,到乙接棒时乙跑过的距离为
处开始起跑,到乙接棒时乙跑过的距离为.files/image281.gif)
根据运动学公式有.files/image294.gif) 2分
2分
.files/image296.gif) 2分
2分
且.files/image298.gif) 2分
2分
解得.files/image300.gif) 3分
3分
24.(19分)解:粒子在点场中做类平抛运动,有.files/image302.gif) 设
设.files/image134.gif) 两点间电势差为
两点间电势差为.files/image305.gif) ,由动能定理有
,由动能定理有
.files/image307.gif) 3分
3分
解得:.files/image309.gif) 2分
2分
(2)粒子在.files/image311.gif) 的区域内运动的轨迹如图2所示。设其在匀强磁场中做匀速圆周运动的轨道半径为
的区域内运动的轨迹如图2所示。设其在匀强磁场中做匀速圆周运动的轨道半径为.files/image313.gif) ,磁场的磁感应强度为
,磁场的磁感应强度为.files/image315.gif) 。由题意,粒子做圆周运动的圆心一定在
。由题意,粒子做圆周运动的圆心一定在.files/image223.gif) 轴上
轴上
.files/image318.jpg) 由牛顿第二定律
由牛顿第二定律.files/image320.gif) 2分
2分
解得.files/image322.gif) 1分
1分
由几何知道得.files/image324.gif) 1分
1分
解得.files/image326.gif) 1分
1分
所以.files/image328.gif) 2分
2分
(3)由题意,当以粒子进入磁场的位置和射出磁场的位置的连线作为磁场的直径时,磁场面积最小 1分
设磁场的最小面积为.files/image330.gif)
由几何知道得磁场面积最小时的半径.files/image332.gif) 2分
2分
解得最小面积为.files/image334.gif)
.files/image335.jpg) 25.(20分)解:(1)金属棒在图3所示各力作用下,先做加速度逐渐减小的加速运动,当加速度为零时,金属棒达到最大速度,此后开始做匀速直线运动。设最大速度为
25.(20分)解:(1)金属棒在图3所示各力作用下,先做加速度逐渐减小的加速运动,当加速度为零时,金属棒达到最大速度,此后开始做匀速直线运动。设最大速度为.files/image337.gif) ,金属棒达到最大速度的一半时的加速度为
,金属棒达到最大速度的一半时的加速度为.files/image095.gif)
.files/image340.jpg) 则速度达到最大时有
则速度达到最大时有.files/image342.gif) 1分
1分
.files/image344.gif) 1分
1分
.files/image346.gif) 1分
1分
由以上各式解得 .files/image348.gif) 1分
1分
金属棒达到最大速度的一半时,由牛顿第二定律有
.files/image350.gif) 2分
2分
.files/image352.gif)
解得.files/image354.gif) 1分
1分
(2)设整个电路放出的电热为.files/image146.gif) ,由能量守恒定律有
,由能量守恒定律有
.files/image357.gif) 2分
2分
代入上面的.files/image337.gif) 值,可得
值,可得.files/image360.gif) 1分
1分
因.files/image362.gif)
故金属棒放出的电热.files/image364.gif) 2分
2分
(3).files/image366.gif) 上消耗的功率
上消耗的功率.files/image368.gif) 1分
1分
.files/image370.gif)
.files/image372.gif)
.files/image374.gif) 3分
3分
.files/image376.gif) 1分
1分
当.files/image378.gif) 时
1分
时
1分
.files/image366.gif) 消耗的功率最大
消耗的功率最大 .files/image381.gif) 2分
2分
26.(13分)
(1).files/image223.gif) 的电子式:
的电子式:.files/image384.jpg) 2分 非极性1分
2分 非极性1分
(2)87 1分
(3)C 1分
(4)碱(1分) .files/image386.gif) 2分
2分
.files/image388.gif) 2分
2分
(5).files/image390.gif) 2分 减小1分
2分 减小1分
.files/image392.jpg) 27.(16分)
27.(16分)
(1).files/image394.gif) (2分)
1分
(2分)
1分
(2)①⑥(各1分,共2分。答③不扣分,其余有错扣1分)
(3)羟基1分 羧基1分
.files/image396.jpg)
.files/image398.jpg)
.files/image400.jpg)
28.(16分)
(1).files/image402.gif) 2分 沸腾炉1分
2分 沸腾炉1分
(2)氯酸钾 (或.files/image404.gif) ) 1分 镁条(或
) 1分 镁条(或.files/image406.gif) ) 1分
) 1分
(3).files/image408.gif) 2分
2分
防止产生的.files/image234.gif) 和
和.files/image059.gif) 混和发生爆炸 1分 ,避免
混和发生爆炸 1分 ,避免.files/image234.gif) 和
和.files/image413.gif) 反应,使生成的
反应,使生成的.files/image413.gif) 不纯1分
不纯1分
(4).files/image416.gif) 2分
2分
(5)I.不合理(1分),该反应为放热反应,升高温度会降低.files/image243.gif) 的产率,但温度过低,
的产率,但温度过低,
反应速率很小,经济效益较低。因此,应选择适当的温度。(2分)
29.(15分)
(1)增大铜粉与氧接触面积,使反应迅速、充分(2分)
(2).files/image419.gif) (1分) 排出D中的空气(1分) 关闭
(1分) 排出D中的空气(1分) 关闭.files/image256.gif) (1分) 打开
(1分) 打开.files/image422.gif) (1分)
(1分)
(3)锥形瓶中玻璃管液面上升(1分)
(4).files/image424.gif) (2分)
(2分)
(5)向下调节量气管(或及时关闭.files/image256.gif) ) (1分,其他合理答案也可给分)
) (1分,其他合理答案也可给分)
(6)I.0.0720.files/image427.gif) (2分)
(2分)
Ⅱ.有(1分) E装置中生成100mL、0.0720 .files/image427.gif) 硝酸时产生的
硝酸时产生的.files/image429.gif) 约为80.6mL,而
约为80.6mL,而
试管中原有50mL.files/image419.gif) ,二者之和小于139.00mL,说明生成
,二者之和小于139.00mL,说明生成.files/image432.gif) 的同时有NO生成(2分)
的同时有NO生成(2分)
30.(24分)I(8分,每空2分)
J 天敌 竞争 抵抗力
Ⅱ(16分)
(1)原因:肝细胞利用保存液中葡萄糖有氧呼吸(2分),线粒子体产生的.files/image267.gif) 扩散进入细
扩散进入细
胞质基质中。(1分)改进措施:用不含葡萄糖的保存液(2分)
(2)胰蛋白(2分) (3)结构的完整性(2分)
(4)丙铜酸进一步分解的产物有.files/image267.gif) (2分),检验是否有
(2分),检验是否有.files/image267.gif) 产生可判断丙铜酸是否被
产生可判断丙铜酸是否被
分解。(2分)
(5)分别给1号和2号试管设空白对照组1’和2’,(1分) 1’和2’试管所装物质分
别与1号和2号相同,只是下一步不加入丙铜酸(1分),而加入生理盐水。(1分)
31.(18分)(除(2)②小题每空3分外,其余每空2分)
(1)①.files/image437.gif) ②
②.files/image439.gif) ③
③.files/image441.gif)
(2)①雄鸡全为芦花,雌鸡全为非芦花 ②雌鸡全为芦花,雄鸡有芦花与非芦花两中雌鸡
和雄鸡均有芦花与非芦花两种
(3).files/image443.gif) 在雏鸡阶段淘汰绒羽为黑色且头顶有黄
在雏鸡阶段淘汰绒羽为黑色且头顶有黄
色斑点的个体,其于个体全部保留饲养
.files/image445.gif) www.ks5u.com
www.ks5u.com
(1)配制250mL0.1mol/L的盐酸溶液
| 应称量盐酸体积/mL | 应选用容量瓶的规格/mL | 除容量瓶外还需的其它仪器 |
2.1 2.1 |
250 250 |
量筒、烧杯、玻璃棒、胶头滴管 量筒、烧杯、玻璃棒、胶头滴管 |
A.用30mL水洗涤烧杯2-3次,洗涤液均注入容量瓶,振荡
B.用量筒量准确量取所需的浓盐酸的体积,沿玻璃棒倒入烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入250mL的容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1-2cm处
(3)操作A中,将洗涤液都移入容量瓶,其目的是
(4)若出现如下情况,对所配溶液浓度将有何影响(填“偏高”、“偏低”或“无影响”)若没有进行A操作
(5)若实验过程中出现如下情况如何处理?
加蒸馏水时不慎超过了刻度
向容量瓶中转移溶液时(实验步骤②)不慎有液滴掉在容量瓶外面
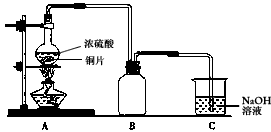
②取少量不溶物,向其中加入几滴浓硝酸,产生大量红棕色气体。
③取少量不溶物,向其中加5mL酒精,充分振荡后,静置、过滤,把滤液移入盛有水的小试管中,振荡,出现浑浊。
④取少量不溶物,向其中加入3mL氨水,振荡,溶液呈无色,在空气中静置,溶液变为深蓝色。
⑤取少量不溶物,向其中加入浓盐酸并加热,沉淀几乎全部溶解。为了解释上述现象,学习小组通过查阅资料了解到。
a.铜与浓硫酸反应的不溶性副产物可能有:CuS、Cu2S、Cu2O、S等物质;
b.CuS和Cu2S都能溶于热的浓盐酸;
c.Cu2O能溶于氨水生成无色的[Cu(NH3)2]+,[Cu(NH3)2]+在氨水中被空气中的氧气氧化成深蓝色的
[Cu(NH3)4]2+。
回答下列问题:
(1)实验结束后,装置C中的溶液中可能含有的溶质有__________________。
(2)第②步操作要注意的问题是_________________________;对比①②两步操作中的现象,你能得到的结论是_________________________。
(3)第③步操作中出现的沉淀是__________________,请解释出现这一现象的原因_______________。
(4)写出④步涉及的离子方程式______________________________。
(5)综合分析铜与浓硫酸的反应,生成的不溶物是___________________________。
(6)某工厂拟用废铜屑制备硫酸铜,请你分析利用上述实验原理是否可行。若可行,请说明理由____________________________________。若不可行,请设计更合理的实验方案(用化学反应方程式表示)
______________________________。

(1)含酚酞的0.01mol?L-1CH3COONa溶液显浅红色的原因为
(2)实验过程中发现烧瓶①中溶液红色变深,烧瓶③中溶液红色变浅,则下列叙述正确的是
A.水解反应为放热反应 B.水解反应为吸热反应
C.NH4NO3溶于水时放出热量 D.NH4NO3溶于水时吸收热量
(3)向0.01mol?L-1CH3COONa溶液中分别加入少量浓盐酸、NaOH固体、Na2CO3固体使水解平衡移动的方向分别为
如图所示三个烧瓶中分别装入含酚酞的0.01 mol·L-1 CH3COONa溶液,并分别放置在盛有水的烧杯中,然后向烧杯①中加入生石灰,向烧杯③中加入NH4NO3晶体,烧杯②中不加任何物质。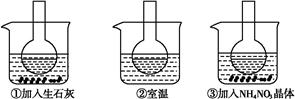
(1)含酚酞的0.01 mol·L-1 CH3COONa溶液显浅红色的原因为
(2)实验过程中发现烧瓶①中溶液红色变深,烧瓶③中溶液红色变浅,则下列叙述正确的是 。
| A.水解反应为放热反应 | B.水解反应为吸热反应 |
| C.NH4NO3溶于水时放出热量 | D.NH4NO3溶于水时吸收热量 |

(1)含酚酞的0.01mol?L-1CH3COONa溶液显浅红色的原因为______.
(2)实验过程中发现烧瓶①中溶液红色变深,烧瓶③中溶液红色变浅,则下列叙述正确的是______.
A.水解反应为放热反应 B.水解反应为吸热反应
C.NH4NO3溶于水时放出热量 D.NH4NO3溶于水时吸收热量
(3)向0.01mol?L-1CH3COONa溶液中分别加入少量浓盐酸、NaOH固体、Na2CO3固体使水解平衡移动的方向分别为______、______.(填“左”“右”或“不移动”).