网址:http://m.1010jiajiao.com/timu_id_50786[举报]
说明:1. 文字简答题以关键词到位为准,按点给分;
2. 化学用语书写:(1)方程式未配平不得分、无条件扣一半分值;
(2)化学式书写错误得0分;
3. 写名称或化学式正确的正常给分; 4. 其他合理解法正常给分。
第Ⅰ卷(选择题,共48分)
题号
1
2
3
4
5
6
7
8
9
10
11
12
13
14
答案
C
D
A
D
C
B
B
C
CD
B
CD
B
AD
A
第Ⅱ卷(非选择题 共72分)
三、(本题包括2小题,共22分)
15.(6分)(1)镁条表面产生气泡(2分)(2)A,B或C或D(2分,各1分)
(3)Mg+Cu2++2H2O=Mg2++Cu(OH)2↓+H2↑ Mg+Cu2+= Mg2++Cu (各1分,共2分)
16.(16分)(1)烧杯、玻璃棒,过滤,换过滤器并重新进行过滤操作(4分,每空1分)
(2)NaOH、Na2CO3(2分) (3)NaOH C (2分,各1分)
(4)除去NaOH和Na2CO3(2分) (5)蒸发皿,蒸发皿中有大量固体析出(2分,各1分)
(6)加快沉淀生成 5.61×10―8 mol?L―1。(4分,各2分)
四、(本题包括2小题,共18分)
17.(8分)(1)小,工业制备硫酸。 (2)MnO2 + 2Fe2+ + 4H+ = Mn2+ + 2Fe3+ + 2H2O。
使Fe2+ 转变为Fe3+,Fe3+完全沉淀的pH较低(或Fe3+更易沉淀)。
(3)与溶液中的酸反应,使溶液中的Fe3+、Al3+转化为氢氧化物沉淀。
(4)使MnCO3沉淀完全。MnCO3沉淀量少,NH4HCO3与酸反应。
(或MnCO3、NH4HCO3与酸反应溶解)
(5)节约能源、治理含SO2的工业废气等。(答对1个即可)(每空1分)
18.(10分)(1)接触室,防止催化剂中毒。(各1分,共2分)
(2)SO2+V2O5 SO3+ V2O4 4VOSO4+O2
SO3+ V2O4 4VOSO4+O2 2V2O5+4SO3(各1分,共2分)
2V2O5+4SO3(各1分,共2分)
(3)400 L?mol―1,使用常压SO2就可以达到较高的转化率。(前者2分,后者1分,共3分)
(4)①②,V2O5+ SO32―+4H+=2VO2++SO42―+2H2O。4和80℃。(各1分,共3分)
五、(本题包括1小题,共14分)
19.(14分)(1)4(2分)
(2) (2分)
(2分) (2分)
(2分)
(3)保护醛基不被还原。(2分)
(4)RCHO + 2Ag(NH3)2+
+ 2OH-  RCOO― +NH4+ +2Ag↓+3NH3 + H2O
(2分)
RCOO― +NH4+ +2Ag↓+3NH3 + H2O
(2分)
(5)(4分,对1步给2分,对2步给3分,全对给4分)

六、(本题包括1小题,共8分)
20.(8分)解:(1)6Fe2++ClO3-+6H+===6Fe3++Cl-+3H2O (2分)
(2)n(Fe)=2.80g/160g?mol-1×2=0.035mol
n(SO42-)=10.48 g /233 g?mol-1=0.045mol
n(OH-)=3×n(Fe)-2×n(SO42-)=3×0.035-2×0.045=0.015mol (2分)
盐基度=n(OH-)/3n(Fe)×100%
= 0.015 mol/(3×0.035 mol) ×100%
=14.29% (2分)
(3)n(H2O)=(7.51g―0.035mol×56g?mol -1-0.045mol×96 g?mol-1-0.015mol×17 g?mol-1)/18 g?mol-1=0.054 mol
化学式: Fe35(OH)15(SO4)45?54H2O (2分)
七、选做题(下面两题分别对应于“物质结构与性质”和“实验化学”两个选修课程模块的内容,请你选择其中一题作答,如果你两题全做,按第一题评分。每题均为10分。)
22. (A) (1)第四周期,第Ⅷ族 (1分) (2)CN― C22- sp3 液态氨汽化时需吸收大量的热 2 (各1分,共4分)
(3) [Ar]3d7;或 (1分)2NiO(OH) + 6HCl(浓)=2NiCl2+Cl2↑+4H2O;(1分)
(1分)2NiO(OH) + 6HCl(浓)=2NiCl2+Cl2↑+4H2O;(1分)
(4)x=5(1分) LaNi5H6+6OH- -6e-==LaNi5+6H2O (2分)
21.(B)22(B)(1)固定试管(2分) 容量瓶 酸式滴定管 烧杯(共2分,答对1-2个给1分,全对给2分)
(2)Al2O3 + 2NaOH =2NaAlO2 +H2O, 作用:去除铝箔表面的氧化膜 2Al + 3HgCl2 =2AlCl3 + 3Hg ,Al + Hg =Al (Hg) (铝汞齐), 作用:形成铝汞齐破坏致密氧化膜的形成(共2分)
(3)打开橡皮塞,用火柴点燃,出现轻微“噗”声或尖锐爆鸣声皆能说明有H2生成。(2分)
(4)原因分别是:浓硫酸具有吸水性,溢出后吸收空气的水变成稀硫酸,而稀硫酸与铝的氧化膜及铝本身皆发生反应;浓硝酸具有挥发性,溢出后因挥发同样会变稀,变稀的硝酸与氧化膜及铝本身亦发生反应。(各1分,2分)
 (2012?西安二模)镍(Ni)是一种重要的金属,在材料科学等领域有广泛应用.
(2012?西安二模)镍(Ni)是一种重要的金属,在材料科学等领域有广泛应用.(1)Ni在元素周期表中的位置是
(2)镍易形成配合物,如:Ni(CO)4、[Ni(NH3)6]2+ 等.写出一种与配体CO互为等电子体的阴离子
(3)镍常见化合价为+2、+3,在水溶液中通常只以+2 价离子的形式存在.+3价的镍离子具有很强的氧化性,在水中会与水或酸根离子迅速发生氧化还原反应.Ni3+的电子排布式为
(4)镍和镧(
139 57 |
LaNixHy+y NiO(OH)
| 放电 |
| 充电 |
(1)Ni在元素周期表中的位置是______.
(2)镍易形成配合物,如:Ni(CO)4、[Ni(NH3)6]2+ 等.写出一种与配体CO互为等电子体的阴离子______.配体NH3中N原子的杂化类型为______,它可用作致冷剂的原因是______.若[Ni(NH3)6]2+ 为正八面体构型,则[Ni(CO)2(NH3)4]2+的结构有______种.
(3)镍常见化合价为+2、+3,在水溶液中通常只以+2 价离子的形式存在.+3价的镍离子具有很强的氧化性,在水中会与水或酸根离子迅速发生氧化还原反应.Ni3+的电子排布式为______,NiO(OH)溶于浓盐酸的化学方程式为______.
(4)镍和镧(
| 13957 |
LaNixHy+y NiO(OH)
| 放电 |
| 充电 |
(1)Ni在元素周期表中的位置是______.
(2)镍易形成配合物,如:Ni(CO)4、[Ni(NH3)6]2+ 等.写出一种与配体CO互为等电子体的阴离子______.配体NH3中N原子的杂化类型为______,它可用作致冷剂的原因是______.若[Ni(NH3)6]2+ 为正八面体构型,则[Ni(CO)2(NH3)4]2+的结构有______种.
(3)镍常见化合价为+2、+3,在水溶液中通常只以+2 价离子的形式存在.+3价的镍离子具有很强的氧化性,在水中会与水或酸根离子迅速发生氧化还原反应.Ni3+的电子排布式为______,NiO(OH)溶于浓盐酸的化学方程式为______.
(4)镍和镧(
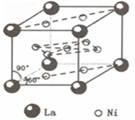
 )组成的一种合金LaNix是较好的储氢材料,能快速可逆地存储和释放H2.LaNix的晶胞如图,其储氢原理为:镧镍合金吸附H2,H2解离为原子,H储存在其中形成LaNixH6.LaNixH6中,x=______.该贮氢的镧镍合金、泡沫氧化镍、氢氧化钾溶液组成的镍氢电池被用于制作原子钟,反应原理为:
)组成的一种合金LaNix是较好的储氢材料,能快速可逆地存储和释放H2.LaNix的晶胞如图,其储氢原理为:镧镍合金吸附H2,H2解离为原子,H储存在其中形成LaNixH6.LaNixH6中,x=______.该贮氢的镧镍合金、泡沫氧化镍、氢氧化钾溶液组成的镍氢电池被用于制作原子钟,反应原理为:LaNixHy+y NiO(OH)
 LaNix+y NiO+y H2O.写出其放电时负极的电极反应方程式______.
LaNix+y NiO+y H2O.写出其放电时负极的电极反应方程式______. 查看习题详情和答案>>
查看习题详情和答案>>
 <化学--选修3:物质结构>
<化学--选修3:物质结构>镍(Ni)是一种重要的金属,在材料科学等领域有广泛应用.
(1)Ni在元素周期表中的位置是
(2)镍易形成配合物,如:Ni(CO)4、[Ni(NH3)6]2+ 等.写出一种与配体CO互为等电子体的阴离子
(3)镍常见化合价为+2、+3,在水溶液中通常只以+2 价离子的形式存在.+3价的镍离子具有很强的氧化性,在水中会与水或酸根离子迅速发生氧化还原反应.Ni3+的电子排布式为
(4)镍和镧(
139 57 |
(18分)镍(Ni)是一种重要的金属,在材料科学等领域有广泛应用。
(1)Ni在元素周期表中的位置是 。
(2)镍易形成配合物,如:Ni(CO)4、[Ni(NH3)6]2+ 等。写出一种与配体CO互为等电子体的阴离子 。配体NH3中N原子的杂化类型为 , 它可用作致冷剂的原因是 。若[Ni(NH3)6]2+ 为正八面体构型,则[Ni(CO)2(NH3)4] 2+的结构有 种。
(3)镍常见化合价为+2、+3, 在水溶液中通常只以+2 价离子的形式存在。+3价的镍离子具有很强的氧化性,在水中会与水或酸根离子迅速发生氧化还原反应。Ni3+的电子排布式为 ,NiO(OH)溶于浓盐酸的化学方程式为 。
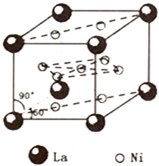
(4)镍和镧(![]() )组成的一种合金LaNix是较好的储氢材料,能快速可逆地存储和释放H2。LaNix的晶胞如图,其储氢原理为:镧镍合金吸附H2,H2解离为原子,H储存在其中形成LaNixH6。LaNixH6中,x= 。该贮氢的镧镍合金、泡沫氧化镍、氢氧化钾溶液组成的镍氢电池被用于制作原子钟,反应原理为:
)组成的一种合金LaNix是较好的储氢材料,能快速可逆地存储和释放H2。LaNix的晶胞如图,其储氢原理为:镧镍合金吸附H2,H2解离为原子,H储存在其中形成LaNixH6。LaNixH6中,x= 。该贮氢的镧镍合金、泡沫氧化镍、氢氧化钾溶液组成的镍氢电池被用于制作原子钟,反应原理为:
LaNixHy+y NiO(OH) LaNix+y NiO+y H2O。写出其放电时负极的电极反应方程式
查看习题详情和答案>>