网址:http://m.1010jiajiao.com/timu_id_50765[举报]
说明:1. 文字简答题以关键词到位为准,按点给分;
2. 化学用语书写:(1)方程式未配平不得分、无条件扣一半分值;
(2)化学式书写错误得0分;
3. 写名称或化学式正确的正常给分; 4. 其他合理解法正常给分。
第Ⅰ卷(选择题,共48分)
题号
1
2
3
4
5
6
7
8
9
10
11
12
13
14
答案
C
D
A
D
C
B
B
C
CD
B
CD
B
AD
A
第Ⅱ卷(非选择题 共72分)
三、(本题包括2小题,共22分)
15.(6分)(1)镁条表面产生气泡(2分)(2)A,B或C或D(2分,各1分)
(3)Mg+Cu2++2H2O=Mg2++Cu(OH)2↓+H2↑ Mg+Cu2+= Mg2++Cu (各1分,共2分)
16.(16分)(1)烧杯、玻璃棒,过滤,换过滤器并重新进行过滤操作(4分,每空1分)
(2)NaOH、Na2CO3(2分) (3)NaOH C (2分,各1分)
(4)除去NaOH和Na2CO3(2分) (5)蒸发皿,蒸发皿中有大量固体析出(2分,各1分)
(6)加快沉淀生成 5.61×10―8 mol?L―1。(4分,各2分)
四、(本题包括2小题,共18分)
17.(8分)(1)小,工业制备硫酸。 (2)MnO2 + 2Fe2+ + 4H+ = Mn2+ + 2Fe3+ + 2H2O。
使Fe2+ 转变为Fe3+,Fe3+完全沉淀的pH较低(或Fe3+更易沉淀)。
(3)与溶液中的酸反应,使溶液中的Fe3+、Al3+转化为氢氧化物沉淀。
(4)使MnCO3沉淀完全。MnCO3沉淀量少,NH4HCO3与酸反应。
(或MnCO3、NH4HCO3与酸反应溶解)
(5)节约能源、治理含SO2的工业废气等。(答对1个即可)(每空1分)
18.(10分)(1)接触室,防止催化剂中毒。(各1分,共2分)
(2)SO2+V2O5 SO3+ V2O4 4VOSO4+O2
SO3+ V2O4 4VOSO4+O2 2V2O5+4SO3(各1分,共2分)
2V2O5+4SO3(各1分,共2分)
(3)400 L?mol―1,使用常压SO2就可以达到较高的转化率。(前者2分,后者1分,共3分)
(4)①②,V2O5+ SO32―+4H+=2VO2++SO42―+2H2O。4和80℃。(各1分,共3分)
五、(本题包括1小题,共14分)
19.(14分)(1)4(2分)
(2) (2分)
(2分) (2分)
(2分)
(3)保护醛基不被还原。(2分)
(4)RCHO + 2Ag(NH3)2+
+ 2OH-  RCOO― +NH4+ +2Ag↓+3NH3 + H2O
(2分)
RCOO― +NH4+ +2Ag↓+3NH3 + H2O
(2分)
(5)(4分,对1步给2分,对2步给3分,全对给4分)

六、(本题包括1小题,共8分)
20.(8分)解:(1)6Fe2++ClO3-+6H+===6Fe3++Cl-+3H2O (2分)
(2)n(Fe)=2.80g/160g?mol-1×2=0.035mol
n(SO42-)=10.48 g /233 g?mol-1=0.045mol
n(OH-)=3×n(Fe)-2×n(SO42-)=3×0.035-2×0.045=0.015mol (2分)
盐基度=n(OH-)/3n(Fe)×100%
= 0.015 mol/(3×0.035 mol) ×100%
=14.29% (2分)
(3)n(H2O)=(7.51g―0.035mol×56g?mol -1-0.045mol×96 g?mol-1-0.015mol×17 g?mol-1)/18 g?mol-1=0.054 mol
化学式: Fe35(OH)15(SO4)45?54H2O (2分)
七、选做题(下面两题分别对应于“物质结构与性质”和“实验化学”两个选修课程模块的内容,请你选择其中一题作答,如果你两题全做,按第一题评分。每题均为10分。)
22. (A) (1)第四周期,第Ⅷ族 (1分) (2)CN― C22- sp3 液态氨汽化时需吸收大量的热 2 (各1分,共4分)
(3) [Ar]3d7;或 (1分)2NiO(OH) + 6HCl(浓)=2NiCl2+Cl2↑+4H2O;(1分)
(1分)2NiO(OH) + 6HCl(浓)=2NiCl2+Cl2↑+4H2O;(1分)
(4)x=5(1分) LaNi5H6+6OH- -6e-==LaNi5+6H2O (2分)
21.(B)22(B)(1)固定试管(2分) 容量瓶 酸式滴定管 烧杯(共2分,答对1-2个给1分,全对给2分)
(2)Al2O3 + 2NaOH =2NaAlO2 +H2O, 作用:去除铝箔表面的氧化膜 2Al + 3HgCl2 =2AlCl3 + 3Hg ,Al + Hg =Al (Hg) (铝汞齐), 作用:形成铝汞齐破坏致密氧化膜的形成(共2分)
(3)打开橡皮塞,用火柴点燃,出现轻微“噗”声或尖锐爆鸣声皆能说明有H2生成。(2分)
(4)原因分别是:浓硫酸具有吸水性,溢出后吸收空气的水变成稀硫酸,而稀硫酸与铝的氧化膜及铝本身皆发生反应;浓硝酸具有挥发性,溢出后因挥发同样会变稀,变稀的硝酸与氧化膜及铝本身亦发生反应。(各1分,2分)
(9分)在20.0 mL 0.10 mol·L-1的盐酸溶液中滴加0.10mol·L-1 NaOH溶液,并以酚酞为指示剂。
(1)填写下表中的空格(结果保留一位小数)。
| ① V(NaOH)(mL) | 0.00 | 18.00 | 19.80 | 19.96 | 19.98 | 20.00 | 20.02 | 20.04 | 20.20 |
| ②溶液的pH | 1.0 | 2.3 | 3.3 |
| 4.3 | 7 | 9.7 |
| 10.7 |
(2)根据上表中的数据,画出滴定过程中溶液的pH与加入NaOH溶液体积的关系示意
图,并指出该滴定曲线的特点。
(3)一般中和滴定操作要求误差≤0.1%,其关键之一是选择合适的指示剂来确定终点。你认为能否用甲基橙作上述反应的指示剂,说明理由。
(4)其实滴定的方法有多种,除上述实验中的酸碱中和滴定外,还有沉淀滴定、络合滴定等。沉淀滴定所用的指示剂本身就是一种沉淀剂,滴定剂和被滴定物的生成物的溶解度要比滴定剂和指示剂生成物的溶解度________(填“大”、“小”或“相同”),否则不能用这种指示剂。如用AgNO3溶液滴定溶液中的Cl-的含量时常以CrO42 -为指示剂,这是因为AgCl比Ag2CrO4更______溶的缘故。
查看习题详情和答案>>
(9分)在20.0 mL 0.10 mol·L-1的盐酸溶液中滴加0.10mol·L-1 NaOH溶液,并以酚酞为指示剂。
(1)填写下表中的空格(结果保留一位小数)。
|
① V(NaOH)(mL) |
0.00 |
18.00 |
19.80 |
19.96 |
19.98 |
20.00 |
20.02 |
20.04 |
20.20 |
|
②溶液的pH |
1.0 |
2.3 |
3.3 |
|
4.3 |
7 |
9.7 |
|
10.7 |
(2)根据上表中的数据,画出滴定过程中溶液的pH与加入NaOH溶液体积的关系示意
图,并指出该滴定曲线的特点。
(3)一般中和滴定操作要求误差≤0.1%,其关键之一是选择合适的指示剂来确定终点。你认为能否用甲基橙作上述反应的指示剂,说明理由。
(4)其实滴定的方法有多种,除上述实验中的酸碱中和滴定外,还有沉淀滴定、络合滴定等。沉淀滴定所用的指示剂本身就是一种沉淀剂,滴定剂和被滴定物的生成物的溶解度要比滴定剂和指示剂生成物的溶解度________(填“大”、“小”或“相同”),否则不能用这种指示剂。如用AgNO3溶液滴定溶液中的Cl-的含量时常以CrO42 -为指示剂,这是因为AgCl比Ag2CrO4更______溶的缘故。
查看习题详情和答案>>
在20.0 mL 0.10 mol·L-1的盐酸溶液中滴加0.10mol·L-1 NaOH溶液,并以酚酞为指示剂。
(1)填写下表中的空格(结果保留一位小数)。
| ① V(NaOH)(mL) | 0.00 | 18.00 | 19.80 | 19.96 | 19.98 | 20.00 | 20.02 | 20.04 | 20.20 |
| ②溶液的pH | 1.0 | 2.3 | 3.3 | 4.3 | 7 | 9.7 | 10.7 |
(2)根据上表中的数据,画出滴定过程中溶液的pH与加入NaOH溶液体积的关系示意
图,并指出该滴定曲线的特点。
(3)一般中和滴定操作要求误差≤0.1%,其关键之一是选择合适的指示剂来确定终点。你认为能否用甲基橙作上述反应的指示剂,说明理由。
(4)其实滴定的方法有多种,除上述实验中的酸碱中和滴定外,还有沉淀滴定、络合滴定等。沉淀滴定所用的指示剂本身就是一种沉淀剂,滴定剂和被滴定物的生成物的溶解度要比滴定剂和指示剂生成物的溶解度________(填“大”、“小”或“相同”),否则不能用这种指示剂。如用AgNO3溶液滴定溶液中的Cl-的含量时常以CrO42 -为指示剂,这是因为AgCl比Ag2CrO4更______溶的缘故。
查看习题详情和答案>>水钴矿中除SiO2外,还有9.24% CoO、2.78% Fe2O3、0.96% MgO、0.084 % CaO。从中提取钴的主要工艺流程如下:

(1)在一定浓度的H2SO4溶液中,钴的浸出率随时间、温度的变化如图所示。考虑生产成本和效率,最佳的浸出时间为 小时,最佳的浸出温度为 ℃。

(2)请配平下列除铁的化学方程式:
Fe2(SO4)3+ H2O+ Na2CO3= Na2Fe6(SO4)4(OH)12↓+ Na2SO4+ CO2↑
(3)“除钙、镁”的原理反应为:MgSO4+2NaF=MgF2↓+Na2SO4 ;CaSO4+2NaF=CaF2↓+Na2SO4
已知Ksp(CaF2)=1.11×10-10,Ksp(MgF2)=7.40×10-11,加入过量NaF溶液反应完全后过滤,则滤液中 。
。
(4)“沉淀”中含杂质离子主要有SO42-、F-、 和 ;“操作X”包括 和 。
(5)某锂离子电池正极是LiCoO2,含Li+导电固体为电解质。充电时,Li+还原为Li,并以原子形式嵌入电池负极材料碳-6(C6)中(如图所示)。电池反应为LiCoO2
+C6  CoO2
+LiC6 ,写出该电池放电时的正极反应式
。
CoO2
+LiC6 ,写出该电池放电时的正极反应式
。

查看习题详情和答案>>
水钴矿中除SiO2外,还有9.24% CoO、2.78% Fe2O3、0.96% MgO、0.084 % CaO。从中提取钴的主要工艺流程如下: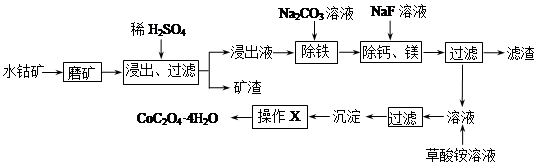
(1)在一定浓度的H2SO4溶液中,钴的浸出率随时间、温度的变化如图所示。考虑生产成本和效率,最佳的浸出时间为 小时,最佳的浸出温度为 ℃。
(2)请配平下列除铁的化学方程式:
Fe2(SO4)3+ H2O+ Na2CO3= Na2Fe6(SO4)4(OH)12↓+ Na2SO4+ CO2↑
(3)“除钙、镁”的原理反应为:MgSO4+2NaF=MgF2↓+Na2SO4 ;CaSO4+2NaF=CaF2↓+Na2SO4
已知Ksp(CaF2)=1.11×10-10,Ksp(MgF2)=7.40×10-11,加入过量NaF溶液反应完全后过滤,则滤液中 。
。
(4)“沉淀”中含杂质离子主要有SO42-、F-、 和 ;“操作X”包括 和 。
(5)某锂离子电池正极是LiCoO2,含Li+导电固体为电解质。充电时,Li+还原为Li,并以原子形式嵌入电池负极材料碳-6(C6)中(如图所示)。电池反应为LiCoO2+C6  CoO2+LiC6,写出该电池放电时的正极反应式 。
CoO2+LiC6,写出该电池放电时的正极反应式 。