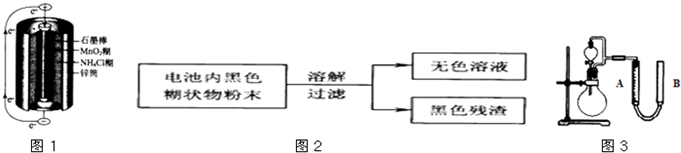
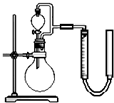
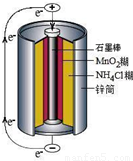
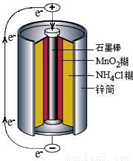
摘要:⑴如图是干电池的基本构造图.干电池工作时正板上的反应是NH4++e―=NH3+H2.则负极上的电极反应式是 .MnO2的作用是除去正极上的产物.本身生成Mn2O3.该反应的化学方程式是 , ⑵锌皮和碳棒的回收:用钳子和剪子剪开回收的干电池的锌筒.将锌皮和碳棒取出.刷洗干净.将电池内的黑色粉末移入小烧杯中. ⑶氯化铵.氯化锌的提取.检验和分离① 如何从黑色粉末中提取NH4Cl和ZnCl2等晶体的混合物?写出简要的实验步骤: ② 设计简单的实验证明所得晶体中含有NH4+和Zn2+2是两性氢氧化物且能溶解于氨水),并填写下列实验报告.实验步骤实验现象实验结论有关离子方程式取少量晶体溶于蒸馏水配成溶液
网址:http://m.1010jiajiao.com/timu_id_5036[举报]
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
A
A
A
C
B
A
C
BC
D
D
AC
C
CD
AC
D
16.(一)ABDG (二)(1)温度对KIO3稳定性的影响?(或油炸食品是否适宜放碘盐)研究报告、实验报告、论文等.(2)IO3―+5I―+6H+====3I2+3H2O
17. (1)Zn-2e―==Zn2+,2MnO2+H2===Mn2O3+H2O
(3)①向小烧杯中加入一定量的热蒸馏水,充分搅拌,趁热过滤,将滤液冷却,再过滤得晶体,所得晶体即为ZnCl2、NH4Cl;②A.取少许溶液,加NaOH加热,在试管口放湿润红色石蕊试纸;B.试纸变蓝;C.NH4+OH―==NH3+H2O晶体混合物;D.取少许溶液,加……(或氨水),将悬浊液分成两份,一份加稀HCl,一份加足量氨水;E.先白色沉淀,后沉淀都溶解;③加热法;(4)坩埚、玻璃棒(三脚架、泥三角、坩埚钳等)
18.⑴排出装置中的空气(CO2、N2、H2O等);⑵AD,D;
⑶

⑷ 除去过量O2,保证最终收集的气体是反应生成的N2;
⑸水,若是气体,则不能被收集和测量,导致较大误差,充满水时能保证进入装置E的气体体积与排出水的体积基本相当;
⑹①使E、F中的液面相平;②视线与量筒内凹液面最低处相平,
⑺A B D;⑻不能,因为CO2、H2O会被碱石灰同时吸收,使实验结果缺少必要数据
19.⑴同周期从左→右电负性逐渐增大(或同主族……)
⑵2.0<x<2.4,弱;⑶得电子;⑷共价键
20.⑴还原剂;2Fe3++Fe==3Fe2+;⑵重结晶,FeSO4?7H2O;
⑶促进Ti4+完全水解生成沉淀;
 21.⑴Al4C3 ;Na2O2 ;NH3;(2)2NA
21.⑴Al4C3 ;Na2O2 ;NH3;(2)2NA (4)2AlO2- + CO2 +3H2O =2 Al(OH)3
+CO32- ;Al(OH)3
+ 3H+ = Al3+ + 3H2O
(4)2AlO2- + CO2 +3H2O =2 Al(OH)3
+CO32- ;Al(OH)3
+ 3H+ = Al3+ + 3H2O
 ⑵F
H
⑵F
H

 ∴
∴
 ,富氧空气体积为
,富氧空气体积为
 ,∴
,∴
 锌锰干电池是最早使用的化学电池,其基本构造如图所示.
锌锰干电池是最早使用的化学电池,其基本构造如图所示.