网址:http://m.1010jiajiao.com/timu_id_495340[举报]
例1:D 例2:D 例3:D 例4:B 例5:A 例6:BD
例7:(1)2 4 2 2 1 2 ;H2O
(2) ② (3)0.2 (4)2.63
例8:(1)①KI+IBr=KBr+I2
②C6H6+ICl→C6H5I+HCl或 +HCl→
+HCl→ -I+HCl
-I+HCl
(2)相对分子质量越大,分子间的作用力越强
(3)介于Br2的沸点和IBr的沸点之间
例9:(1)A,B (2)非金属;因为A+B→乙+C,且乙为单质,可知乙元素在A,B中分别呈正、负价,所以乙是非金属。(注:答案中必须体现出“乙元素在A,B中分别呈正、负价”的含义,否则不给分。) (3)S,H2S(或:N2,NH3)
例10、(1)1 5 4 10 11 6 7 2 (10和11可颠倒)[说明:错一个即不给分] (2)驱赶装置中空气,防止反应产生的NO被氧化 (3)通入O2后装置(D)中有红棕色气体生成
(4)分离NO和NO2(或使NO2液化)(5)4NO2+O2+4NaOH=4NaNO3+2H2O
例11、(一)测定铜粉样品中铜的质量分数
(三)
B、E中有气泡产生
2H2O2 2H2O+O2↑
2H2O+O2↑
G中的红褐色粉末变成黑色
2Cu+O2 2CuO
2CuO
C+O2 CO2
CO2
(四)
(五)偏小:水蒸汽通过G被D中碱石灰吸收;洗气瓶 浓硫酸 (或干燥管 碱石灰)
例12、(1)减少CO和碳氢化合物的污染;光化学烟雾或破坏臭氧层
(2)溶液显色所需要的时间
(3)A:汽车尾气中含有一定量的CO和碳氢化合物,少消耗NH3
或B:汽车尾气中含有一定量的NO2,多消耗NH3
或C:汽车尾气中同时含有CO、碳氢化合物等还原性气体和NO2等氧化性气体,二者相对含量的不同可导致消耗NH3的增多或减少
例13、(1)将含氰化合物全部转化为CN - (2)完全吸收HCN,防止气体放空
(3)防止倒吸 (4)偏高 (5)109.2
例14、(1)①BaCl2、NaOH、Na2CO3(错选或多选本小题不得分。NaOH溶液的加入顺序及是否答NaOH不影响得分);②75%乙醇;(2)天平、烧杯、500mL容量瓶、胶头滴管;(3)< 电解生成的氯气与电解生成的NaOH发生了反应 酸碱中和滴定;(4)e d
例15、(1)a、b
(2)干燥气体 控制氢气和氮气的流速
(3)不会 因为混合气体中含有大量难溶于水的氮、氢两种气体
(4)说明氨的氧化反应是一个放热反应 有红棕色气体产生
(5)4NH3十5O2 4NO+6H2O (6)NH4+
NO3-
4NO+6H2O (6)NH4+
NO3-
智能训练:
1、A 2、C 3、B 4、AC 5、AB 6、D 7、C 8、B 9、B 10、A 11、B
12、A 13、B 14、D 15、C 16、A 17、D 18、A 19、C 20、C 21、C
22、C 23、D
24、(1)H2O2 + Mn2+ = MnO2 + 2H+ H2O2 +MnO2 + 2H+ = H2O + Mn2+ +O2↑
(2)5H2O2+2KMnO4+3H2SO4=K2SO4+2MnSO4+8H2O+5O2↑
25、(1)N2可将实验装置内的空气排净,并作为动力源将PbO与C反应生成的气体,赶入B、C两个实验装置处。不可用空气体代替N2,空气中的O2可与灼热的炭反应,且空气中还含有CO2、H2O等含氧化合物,均可导致实验失败。 (2) PbO+C Pb+CO↑,在装置C处可见一氧化碳燃烧产生的淡蓝色火焰。(3)可在装置B后串联一个内盛[Cu(NH3)2]Ac溶液的洗气装置,吸收一氧化碳,反应完毕,取出吸收液加热解吸,用排水取气法收集放出的气体,通过进一步实验证明该气体是一氧化碳。 (4)可用H2代替N2和木炭,PbO+H2
Pb+CO↑,在装置C处可见一氧化碳燃烧产生的淡蓝色火焰。(3)可在装置B后串联一个内盛[Cu(NH3)2]Ac溶液的洗气装置,吸收一氧化碳,反应完毕,取出吸收液加热解吸,用排水取气法收集放出的气体,通过进一步实验证明该气体是一氧化碳。 (4)可用H2代替N2和木炭,PbO+H2 Pb+H2O,用无水CuSO4吸收生成的水,证明氧化铅中含有氧元素。装置B应改用内盛CuSO4白色粉末的干燥管。
Pb+H2O,用无水CuSO4吸收生成的水,证明氧化铅中含有氧元素。装置B应改用内盛CuSO4白色粉末的干燥管。
26、(1)B装置中导气管长进短出
(2)①Cu
+ 2H2SO4(浓) CuSO4 + SO2↑+ 2H2O
CuSO4 + SO2↑+ 2H2O
②反应过程中H2SO4被不断消耗,浓硫酸逐渐变稀,至一定浓度就不再与铜片反应 ③A、D
(3)①A、B、C
②甲基橙 能,因为,在含Cu2+、H+的混合溶液中,当以甲基橙为指示剂用标准NaOH溶液进行滴定时,可以有效排除Cu2+的干扰,准确测出H+的物质的量。
27、(1)NaNO2
(2)2Cu(NO3)2
 2CuO+4NO2↑+O2↑
2CuO+4NO2↑+O2↑
石蕊试液逐渐变为红色,液体几乎不被压至装置③中
(3)Ⅱ正确,如果Ⅰ正确,则装置②中气泡应全部消失,不会有液体被压至装置③中;
向装置①中的残留固体加入少量浓硝酸,产生红棕色气体
(4)硝酸盐受热分解的产物与硝酸盐中金属的活泼性有关等
28、(1)如果是亚铁离子干扰,不可能变红之后,一段时间之后变成蓝色
(2)
(3)2SCN-+20H++22NO3-=2SO42-+2CO2↑+N2↑+22NO2↑+10H2O
(4)比较硫氰根离子与氯离子、溴离子、碘离子的还原性强弱
(5)a、加入氧化剂如氯气等必须少量 b、不一定
29、(1)防止因铁粉过量而使滤渣C中合,铁粉与H2SO4反应,生成Fe2+,干扰实验
 (2)防止环境中O2参加反应
(3)铁粉与硫反应是放热的
(2)防止环境中O2参加反应
(3)铁粉与硫反应是放热的
(4)除去混和物中硫粉:3S+6KOH 2K2S+K2SO3+2H2O; CS2
(5)防止H2SO4溶液中溶解的氧气把Fe2+氧化成Fe3+
(6)加热煮沸的KSCN溶液,看是否变为血红色
30、(1)O H Cl N
(2)NH4NO3 NH4++H2O NH3 ?H2O + H+
NH3 ?H2O + H+
(3)2NH3 NH4+ + NH2-
(4)2Na+2NH3 = 2NaNH2 +H2
NH4+ + NH2-
(4)2Na+2NH3 = 2NaNH2 +H2
 31、(1) 电子式略 F2+H2O HFO+HF
31、(1) 电子式略 F2+H2O HFO+HF
 |
 (2)HFO+H2O=HF+H2O2
(2)HFO+H2O=HF+H2O2
(3)2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2↑
32、(1)CO2(或SO2) H2S(或H3PO4) AlCl3(或NaH2PO4)中的任意两组
(2)S A的化合价介于B、C之间
33、(1)非金属 因为B+C→A+X,X为不含该元素的另一化合物,且A为单质,可知A元素在B、C中分别呈正、负价,所以A是非金属。
(2)在一定条件下,本反应用于治理NO对大气的污染,即:4NH3+6NO=5N2+6H2O
(3)5:3 (4)NO+NO2+2OH-=2NO2- +H2O (5)a c e
34、(1)HCl (2)(CN)2+2I-=I2+2CN- (CN)2+2SCN- =2CN- +(SCN)2
(3)N显负价,C显正价 (4)CNO-<CN-<SCN-
35、(1)b、C (2)AgI (3)Ag、NO
36、溶液中n(H+)=
溶液中n(NO3-)=2 n(Cu2+)+n(H+)=0.350 mol
被还原的硝酸的物质的量为0.0500 L×12.0 mol?L-1-0.350 mol=0.250 mol
产生气体的物质的量为 =0.200 mol
=0.200 mol
即n(NO)+n(NO2)+n(N2O4)=0.200 mol ①
铜失去电子的物质的量为 ×2=0.300 mol,根据电子守恒有
×2=0.300 mol,根据电子守恒有
3 n(NO)+n(NO2)+2 n(N2O4)=0.300 mol ②
根据氮元素守恒有n(NO)+n(NO2)+2 n(N2O4)=0.250 mol ③
解①、②、③得:n(NO)=0.0250 mol,n(NO2)=0.125 mol,n(N2O4)=0.0500 mol
37、(1)Fe和FeS (2) n(Fe)=0.0100mol n(FeS)=0.0150mol c(H2S)=0.0500mo/L
(3)
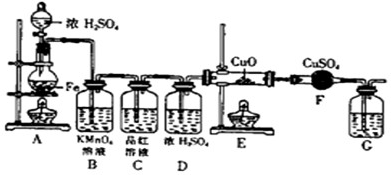
(1)将16克铁粉放入烧瓶中,由分液漏斗放入20mL 18mol/L的浓H2SO4,结果没有任何反应现象,原因是
(2)随着反应的进行,B中酸性KMnO4溶液颜色逐渐变浅(产物中有Mn2+),请用离子方程式表示:
(3)当G处有持续稳定的气泡时,再点燃E处酒精灯,这样操作的原因是
(4)反应一段时间后,E、F处可观察到明显的现象,F处的实验现象
(5)为了确保实验的严谨性和F中现象的可信性,通常在F装置后再接一个装置G,则G中盛放的液体可以是
A.CaCl2溶液 B.Ca(OH)2溶液 C.浓硫酸 D.CCl4
(6)将a mol Fe与含b mol H2SO4的浓硫酸共热,假设按本题的过程进行反应,如果Fe与H2SO4均恰好完全反应,则生成的有
气体1是
气体2是
单质A与粉末化合物B组成的混合物相互转化关系如下图所示:
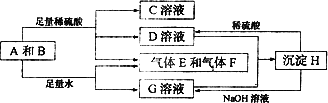
请回答下列问题:
(1)化合物B的电子式为________
(2)D与G两溶液混合后发生反应的离子方程式为________
(3)常温下,D溶液的pH________7(填“>”或“<”或”=”),其原因是________(用离子方程式表示)
(4)用碳棒,稀硫酸,气体E和气体F组成燃料电池,该电池的正极反应式为________.以该电池为电源,用惰性电极电解100 g 8%的C溶液,当电解到溶质的质量分数为12.5%时停止电解,则电解过程中,生成的气体在标准状况下的体积共为________L
单质A与粉末化合物B组成的混合物能发生如图所示的一系列反应: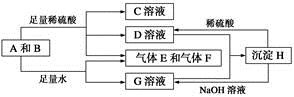
请回答下列问题:
(1)组成A单质的元素在周期表中处于第__________周期__________族。
(2)化合物B的电子式为_____________________________。
(3)D与G两溶液混合后发生反应的离子方程式为____________________
(4)常温下,D溶液的pH________7(填“>”、“<”或“=”),其原因是____________________________(用离子方程式表示)。
(5)10.8 g A单质与足量的NaOH溶液反应,消耗氧化剂的质量为________ g。
(6)用碳棒、稀硫酸、气体E和气体F组成燃料电池,该电池的正极反应式为______________________。以该电池为电源,用惰性电极电解100 g 8%的C溶液,电解到溶质的质量分数为12.5%时停止电解,则电解过程中,生成的气体在准状况下的体积共为________ L,电路上通过电子的物质的量为________ mol。
单质A与粉末化合物B组成的混合物能发生如图所示的一系列反应: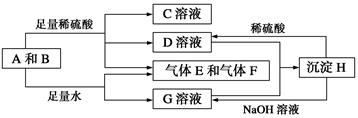
请回答下列问题:
(1)组成A单质的元素在周期表中处于第__________周期__________族。
(2)化合物B的电子式为________________________。
(3)D与G两溶液混合后发生反应的离子方程式为______________________________
(4)常温下,D溶液的pH________7(填“>”、“<”或“=”),其原因是____________________________(用离子方程式表示)。
(5)10.8 g A单质与足量的NaOH溶液反应,消耗氧化剂的质量为________ g。
(6)用碳棒、稀硫酸、气体E和气体F组成燃料电池,该电池的正极反应式为______________________。以该电池为电源,用惰性电极电解100 g 8%的C溶液,电解到溶质的质量分数为12.5%时停止电解,则电解过程中,生成的气体在准状况下的体积共为________ L,电路上通过电子的物质的量为________ mol。
单质A与粉末化合物B组成的混合物能发生如图所示的一系列反应:
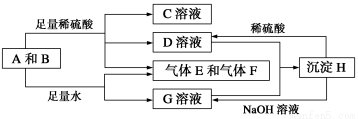
请回答下列问题:
(1)组成A单质的元素在周期表中处于第__________周期__________族。
(2)化合物B的电子式为________________________。
(3)D与G两溶液混合后发生反应的离子方程式为______________________________
(4)常温下,D溶液的pH________7(填“>”、“<”或“=”),其原因是____________________________(用离子方程式表示)。
(5)10.8 g A单质与足量的NaOH溶液反应,消耗氧化剂的质量为________ g。
(6)用碳棒、稀硫酸、气体E和气体F组成燃料电池,该电池的正极反应式为______________________。以该电池为电源,用惰性电极电解100 g 8%的C溶液,电解到溶质的质量分数为12.5%时停止电解,则电解过程中,生成的气体在准状况下的体积共为________ L,电路上通过电子的物质的量为________ mol。
查看习题详情和答案>>