网址:http://m.1010jiajiao.com/timu_id_495285[举报]
例1:D 例2:D 例3:D 例4:B 例5:A 例6:BD
例7:(1)2 4 2 2 1 2 ;H2O
(2) ② (3)0.2 (4)2.63
例8:(1)①KI+IBr=KBr+I2
②C6H6+ICl→C6H5I+HCl或 +HCl→
+HCl→ -I+HCl
-I+HCl
(2)相对分子质量越大,分子间的作用力越强
(3)介于Br2的沸点和IBr的沸点之间
例9:(1)A,B (2)非金属;因为A+B→乙+C,且乙为单质,可知乙元素在A,B中分别呈正、负价,所以乙是非金属。(注:答案中必须体现出“乙元素在A,B中分别呈正、负价”的含义,否则不给分。) (3)S,H2S(或:N2,NH3)
例10、(1)1 5 4 10 11 6 7 2 (10和11可颠倒)[说明:错一个即不给分] (2)驱赶装置中空气,防止反应产生的NO被氧化 (3)通入O2后装置(D)中有红棕色气体生成
(4)分离NO和NO2(或使NO2液化)(5)4NO2+O2+4NaOH=4NaNO3+2H2O
例11、(一)测定铜粉样品中铜的质量分数
(三)
B、E中有气泡产生
2H2O2 2H2O+O2↑
2H2O+O2↑
G中的红褐色粉末变成黑色
2Cu+O2 2CuO
2CuO
C+O2 CO2
CO2
(四)
(五)偏小:水蒸汽通过G被D中碱石灰吸收;洗气瓶 浓硫酸 (或干燥管 碱石灰)
例12、(1)减少CO和碳氢化合物的污染;光化学烟雾或破坏臭氧层
(2)溶液显色所需要的时间
(3)A:汽车尾气中含有一定量的CO和碳氢化合物,少消耗NH3
或B:汽车尾气中含有一定量的NO2,多消耗NH3
或C:汽车尾气中同时含有CO、碳氢化合物等还原性气体和NO2等氧化性气体,二者相对含量的不同可导致消耗NH3的增多或减少
例13、(1)将含氰化合物全部转化为CN - (2)完全吸收HCN,防止气体放空
(3)防止倒吸 (4)偏高 (5)109.2
例14、(1)①BaCl2、NaOH、Na2CO3(错选或多选本小题不得分。NaOH溶液的加入顺序及是否答NaOH不影响得分);②75%乙醇;(2)天平、烧杯、500mL容量瓶、胶头滴管;(3)< 电解生成的氯气与电解生成的NaOH发生了反应 酸碱中和滴定;(4)e d
例15、(1)a、b
(2)干燥气体 控制氢气和氮气的流速
(3)不会 因为混合气体中含有大量难溶于水的氮、氢两种气体
(4)说明氨的氧化反应是一个放热反应 有红棕色气体产生
(5)4NH3十5O2 4NO+6H2O (6)NH4+
NO3-
4NO+6H2O (6)NH4+
NO3-
智能训练:
1、A 2、C 3、B 4、AC 5、AB 6、D 7、C 8、B 9、B 10、A 11、B
12、A 13、B 14、D 15、C 16、A 17、D 18、A 19、C 20、C 21、C
22、C 23、D
24、(1)H2O2 + Mn2+ = MnO2 + 2H+ H2O2 +MnO2 + 2H+ = H2O + Mn2+ +O2↑
(2)5H2O2+2KMnO4+3H2SO4=K2SO4+2MnSO4+8H2O+5O2↑
25、(1)N2可将实验装置内的空气排净,并作为动力源将PbO与C反应生成的气体,赶入B、C两个实验装置处。不可用空气体代替N2,空气中的O2可与灼热的炭反应,且空气中还含有CO2、H2O等含氧化合物,均可导致实验失败。 (2) PbO+C Pb+CO↑,在装置C处可见一氧化碳燃烧产生的淡蓝色火焰。(3)可在装置B后串联一个内盛[Cu(NH3)2]Ac溶液的洗气装置,吸收一氧化碳,反应完毕,取出吸收液加热解吸,用排水取气法收集放出的气体,通过进一步实验证明该气体是一氧化碳。 (4)可用H2代替N2和木炭,PbO+H2
Pb+CO↑,在装置C处可见一氧化碳燃烧产生的淡蓝色火焰。(3)可在装置B后串联一个内盛[Cu(NH3)2]Ac溶液的洗气装置,吸收一氧化碳,反应完毕,取出吸收液加热解吸,用排水取气法收集放出的气体,通过进一步实验证明该气体是一氧化碳。 (4)可用H2代替N2和木炭,PbO+H2 Pb+H2O,用无水CuSO4吸收生成的水,证明氧化铅中含有氧元素。装置B应改用内盛CuSO4白色粉末的干燥管。
Pb+H2O,用无水CuSO4吸收生成的水,证明氧化铅中含有氧元素。装置B应改用内盛CuSO4白色粉末的干燥管。
26、(1)B装置中导气管长进短出
(2)①Cu
+ 2H2SO4(浓) CuSO4 + SO2↑+ 2H2O
CuSO4 + SO2↑+ 2H2O
②反应过程中H2SO4被不断消耗,浓硫酸逐渐变稀,至一定浓度就不再与铜片反应 ③A、D
(3)①A、B、C
②甲基橙 能,因为,在含Cu2+、H+的混合溶液中,当以甲基橙为指示剂用标准NaOH溶液进行滴定时,可以有效排除Cu2+的干扰,准确测出H+的物质的量。
27、(1)NaNO2
(2)2Cu(NO3)2
 2CuO+4NO2↑+O2↑
2CuO+4NO2↑+O2↑
石蕊试液逐渐变为红色,液体几乎不被压至装置③中
(3)Ⅱ正确,如果Ⅰ正确,则装置②中气泡应全部消失,不会有液体被压至装置③中;
向装置①中的残留固体加入少量浓硝酸,产生红棕色气体
(4)硝酸盐受热分解的产物与硝酸盐中金属的活泼性有关等
28、(1)如果是亚铁离子干扰,不可能变红之后,一段时间之后变成蓝色
(2)
(3)2SCN-+20H++22NO3-=2SO42-+2CO2↑+N2↑+22NO2↑+10H2O
(4)比较硫氰根离子与氯离子、溴离子、碘离子的还原性强弱
(5)a、加入氧化剂如氯气等必须少量 b、不一定
29、(1)防止因铁粉过量而使滤渣C中合,铁粉与H2SO4反应,生成Fe2+,干扰实验
 (2)防止环境中O2参加反应
(3)铁粉与硫反应是放热的
(2)防止环境中O2参加反应
(3)铁粉与硫反应是放热的
(4)除去混和物中硫粉:3S+6KOH 2K2S+K2SO3+2H2O; CS2
(5)防止H2SO4溶液中溶解的氧气把Fe2+氧化成Fe3+
(6)加热煮沸的KSCN溶液,看是否变为血红色
30、(1)O H Cl N
(2)NH4NO3 NH4++H2O NH3 ?H2O + H+
NH3 ?H2O + H+
(3)2NH3 NH4+ + NH2-
(4)2Na+2NH3 = 2NaNH2 +H2
NH4+ + NH2-
(4)2Na+2NH3 = 2NaNH2 +H2
 31、(1) 电子式略 F2+H2O HFO+HF
31、(1) 电子式略 F2+H2O HFO+HF
 |
 (2)HFO+H2O=HF+H2O2
(2)HFO+H2O=HF+H2O2
(3)2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2↑
32、(1)CO2(或SO2) H2S(或H3PO4) AlCl3(或NaH2PO4)中的任意两组
(2)S A的化合价介于B、C之间
33、(1)非金属 因为B+C→A+X,X为不含该元素的另一化合物,且A为单质,可知A元素在B、C中分别呈正、负价,所以A是非金属。
(2)在一定条件下,本反应用于治理NO对大气的污染,即:4NH3+6NO=5N2+6H2O
(3)5:3 (4)NO+NO2+2OH-=2NO2- +H2O (5)a c e
34、(1)HCl (2)(CN)2+2I-=I2+2CN- (CN)2+2SCN- =2CN- +(SCN)2
(3)N显负价,C显正价 (4)CNO-<CN-<SCN-
35、(1)b、C (2)AgI (3)Ag、NO
36、溶液中n(H+)=
溶液中n(NO3-)=2 n(Cu2+)+n(H+)=0.350 mol
被还原的硝酸的物质的量为0.0500 L×12.0 mol?L-1-0.350 mol=0.250 mol
产生气体的物质的量为 =0.200 mol
=0.200 mol
即n(NO)+n(NO2)+n(N2O4)=0.200 mol ①
铜失去电子的物质的量为 ×2=0.300 mol,根据电子守恒有
×2=0.300 mol,根据电子守恒有
3 n(NO)+n(NO2)+2 n(N2O4)=0.300 mol ②
根据氮元素守恒有n(NO)+n(NO2)+2 n(N2O4)=0.250 mol ③
解①、②、③得:n(NO)=0.0250 mol,n(NO2)=0.125 mol,n(N2O4)=0.0500 mol
37、(1)Fe和FeS (2) n(Fe)=0.0100mol n(FeS)=0.0150mol c(H2S)=0.0500mo/L
(3)
氧化铜有多种用途,如用作玻璃着色剂,油类脱硫剂等,为获得纯净的氧化铜并探究其性质,某同学查找了溶度积数据并通过计算得到有关信息(见下表),用工业硫酸铜(含硫酸亚铁等杂质)进行如下实验:
| 物 质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
| 完全沉淀时的pH范围 | ≥9.6 | ≥6.4 | 3~4 |
㈠制备氧化铜
![]()
⑴步骤Ⅰ的操作是加入水和少量硫酸溶解样品并过滤,目的是除去不溶性杂质,这一步骤中加酸的作用是 。
⑵步骤Ⅱ的操作是:滴加H2O2溶液,稍加热;待反应完全后,慢慢加入Cu2(OH)2CO3粉末,搅拌,以控制溶液pH=3.5;加热煮沸一段时间,过滤,用稀硫酸酸化滤液至pH=1。
①这一步骤的目的是 ,
②写出加入H2O2溶液时发生反应的离子方程式
③控制溶液pH=3.5的目的是 ,
⑶步骤Ⅲ的目的是得到CuSO4·5H2O晶体,操作是 ,水浴加热烘干所得固体。水浴加热的特点是 。
㈡探究氧化铜性质
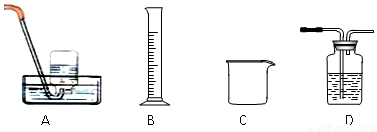
⑴取A、B两支试管,往A中先加入适量CuO粉末,再分别向A和B中加入等体积的3%H2O2溶液,只观察到A中有大量气泡,结论是 。
⑵为探究试管A中反应的速率,收集气体并测定其体积必需的实验仪器或装置为 。(填写序号)
查看习题详情和答案>>
氧化铜有多种用途,如用作玻璃着色剂,油类脱硫剂等,为获得纯净的氧化铜并探究其性质,某同学查找了溶度积数据并通过计算得到有关信息(见下表),用工业硫酸铜(含硫酸亚铁等杂质)进行如下实验:
|
物 质 |
Fe(OH)2 |
Cu(OH)2 |
Fe(OH)3 |
|
完全沉淀时的pH范围 |
≥9.6 |
≥6.4 |
3~4 |
㈠制备氧化铜
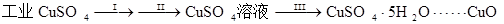
⑴步骤Ⅰ的操作是加入水和少量硫酸溶解样品并过滤,目的是除去不溶性杂质,这一步骤中加酸的作用是 。
⑵步骤Ⅱ的操作是:滴加H2O2溶液,稍加热;待反应完全后,慢慢加入Cu2(OH)2CO3粉末,搅拌,以控制溶液pH=3.5;加热煮沸一段时间,过滤,用稀硫酸酸化滤液至pH=1。
①这一步骤的目的是 ,
②写出加入H2O2溶液时发生反应的离子方程式
③控制溶液pH=3.5的目的是 ,
⑶步骤Ⅲ的目的是得到CuSO4·5H2O晶体,操作是 ,水浴加热烘干所得固体。水浴加热的特点是 。
㈡探究氧化铜性质
⑴取A、B两支试管,往A中先加入适量CuO粉末,再分别向A和B中加入等体积的3%H2O2溶液,只观察到A中有大量气泡,结论是 。
⑵为探究试管A中反应的速率,收集气体并测定其体积必需的实验仪器或装置为 。(填写序号)
查看习题详情和答案>>
氧化铜有多种用途,如用作玻璃着色剂,油类脱硫剂等,为获得纯净的氧化铜并探究其性质,某同学查找了溶度积数据并通过计算得到有关信息(见下表),用工业硫酸铜(含硫酸亚铁等杂质)进行如下实验:
| 物 质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
| 完全沉淀时的pH范围 | ≥9.6 | ≥6.4 | 3~4 |
㈠制备氧化铜
![]()
⑴步骤Ⅰ的操作是加入水和少量硫酸溶解样品并过滤,目的是除去不溶性杂质,这一步骤中加酸的作用是 。
⑵步骤Ⅱ的操作是:滴加H2O2溶液,稍加热;待反应完全后,慢慢加入Cu2(OH)2CO3粉末,搅拌,以控制溶液pH=3.5;加热煮沸一段时间,过滤,用稀硫酸酸化滤液至pH=1。
①这一步骤的目的是 ,
②写出加入H2O2溶液时发生反应的离子方程式
③控制溶液pH=3.5的目的是 ,
⑶步骤Ⅲ的目的是得到CuSO4·5H2O晶体,操作是 ,水浴加热烘干所得固体。水浴加热的特点是 。
㈡探究氧化铜性质
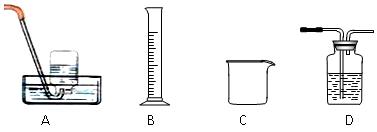
⑴取A、B两支试管,往A中先加入适量CuO粉末,再分别向A和B中加入等体积的3%H2O2溶液,只观察到A中有大量气泡,结论是 。
⑵为探究试管A中反应的速率,收集气体并测定其体积必需的实验仪器或装置为 。(填写序号)
(1)(19分)①研究性学习小组为了证明铁的金属性比铜强,他设计了如下几种方案,其中合理的是 (填序号)
A.铁片置于硫酸铜溶液中有铜析出;
B.铁、铜与氯气反应分别生成FeCl3、CuCl2;
C.铜片置于FeCl3溶液中,铜片逐渐溶解(2FeCl3+Cu=2FeCl2+ CuCl2)
D.铁片、铜片分别置于盛有稀硫酸的烧杯中,铁片上有气泡产生,而铜片无气泡
E.常温下,分别将铁片和铜片置于浓硝酸中,铁片不溶解,而铜片溶解
②请你另设计一个能证明铁的金属活动性比铜强的实验。要求:
a.此方案的原理不同于上述任一合理方案;
b.在方框内绘出实验装置图并注明所需的药品;
c.写出实验过程中的主要实验现象并用相关化学用语解释现象
(2)学完原电池的相关知识后,甲组同学认为构成原电池必须有三个条件:①活动性不同的两极;②电解质溶液;③闭合回路。乙组同学对条件①提出异议,认为相同的两极也可以构成原电池,以下为乙组同学的实验装置简图以及实验报告的部分内容。请仔细阅读实验报告,然后将实验报告补充完整并填在相应的横线上。装置中盐桥的作用之一是使整个装置构成闭合回路。
浓差电池与温差电池
一、【实验目的】
1、电池中两杯溶液及电极均相同,两杯溶液的浓度不同,可否形成原电池
2、电池中两杯溶液及电极均相同,两杯溶液的温度不同,可否形成原电池
3、电池中两杯溶液及电极均相同,研究两杯溶液的 对电池电压和电流的影响
4、电池中两杯溶液及电极均相同,研究两杯溶液的 对电池电压和电流的影响
二、【仪器与药品】略。
三、【实验方法与步骤】
Ⅰ、实验方法:略。
Ⅱ、研究的步骤
㈠实验A:浓差电池
电解液均为硫酸铜,电极均为铜片:
1、甲烧杯中固定装入浓度 0.8 mol/L 的硫酸铜溶液。
2、乙烧杯中分別装入浓度 0.8 mol/L、0.4 mol/L 、0.2 mol/L、0.1 mol/L、0.05 mol/L、0.025 mol/L 的硫酸铜溶液。
3、使用铜片当电极。测量这六种组合电池的稳定电压及电流,将结果记录于表 1。
㈡实验B:温差电池
电解液均为硫酸铜,电极均为铜片:(步骤略,结果记录于表2)
四、【实验结果】
实验A:浓差电池 :表1
| 甲杯硫酸铜浓度 mol/L | 0.8 | 0.8 | 0.8 | 0.8 | 0.8 | 0.8 |
| 乙杯硫酸铜浓度 mol/L | 0.8 | 0.4 | 0.2 | 0.1 | 0.05 | 0.025 |
| 两杯溶液浓度差值 | 0 | 0.4 | 0.6 | 0.7 | 0.75 | 0.775 |
| 电压 mV | 0 | 6 | 12 | 16 | 22 | 26 |
| 电流 mA | 0 | 0.02 | 0.04 | 0.06 | 0.07 | 0.08 |
实验B:温差电池:表2
| 甲杯硫酸铜温度℃ | 19 | 19 | 19 | 19 | 19 | 19 |
| 乙杯硫酸铜温度℃ | 19 | 29 | 39 | 49 | 59 | 69 |
| 两杯溶液温差℃ | 0 | 10 | 20 | 30 | 40 | 50 |
| 电压 mV | 0 | 6.1 | 12 | 20 | 27 | 34 |
| 电流 mA | 0 | 0.025 | 0.047 | 0.07 | 0.15 | 0.18 |
五、【讨论】
1、浓差电池:若硫酸铜浓差电池放电较长一段时间后,可观察到甲杯高浓度的溶液颜色逐渐变浅,而乙杯颜色变深,而电压也逐渐下降,同时可观察到甲杯中铜片表面有铜析出。
这说明:甲杯中的电极反应式为
乙杯中的电极反应式为
电池放电一段较长时间后电压下降的原因:
2、温差电池(略)
六、【结论】
由上述【实验结果】可得结论:
实验A: [来源:学&科&网Z&X&X&K]
实验B:(略)
甲、乙两小组同学给你什么启示:
查看习题详情和答案>>
(1)(19分)①研究性学习小组为了证明铁的金属性比铜强,他设计了如下几种方案,其中合理的是 (填序号)
A.铁片置于硫酸铜溶液中有铜析出;
B.铁、铜与氯气反应分别生成FeCl3、CuCl2;
C.铜片置于FeCl3溶液中,铜片逐渐溶解(2FeCl3+Cu=2FeCl2+ CuCl2)
D.铁片、铜片分别置于盛有稀硫酸的烧杯中,铁片上有气泡产生,而铜片无气泡
E.常温下,分别将铁片和铜片置于浓硝酸中,铁片不溶解,而铜片溶解
②请你另设计一个能证明铁的金属活动性比铜强的实验。要求:
a.此方案的原理不同于上述任一合理方案;
b.在方框内绘出实验装置图并注明所需的药品;
c.写出实验过程中的主要实验现象并用相关化学用语解释现象

(2)学完原电池的相关知识后,甲组同学认为构成原电池必须有三个条件:①活动性不同的两极;②电解质溶液;③闭合回路。乙组同学对条件①提出异议,认为相同的两极也可以构成原电池,以下为乙组同学的实验装置简图以及实验报告的部分内容。请仔细阅读实验报告,然后将实验报告补充完整并填在相应的横线上。装置中盐桥的作用之一是使整个装置构成闭合回路。

浓差电池与温差电池
一、【实验目的】
1、电池中两杯溶液及电极均相同,两杯溶液的浓度不同,可否形成原电池
2、电池中两杯溶液及电极均相同,两杯溶液的温度不同,可否形成原电池
3、电池中两杯溶液及电极均相同,研究两杯溶液的 对电池电压和电流的影响
4、电池中两杯溶液及电极均相同,研究两杯溶液的 对电池电压和电流的影响
二、【仪器与药品】略。
三、【实验方法与步骤】
Ⅰ、实验方法:略。
Ⅱ、研究的步骤
㈠实验A:浓差电池
电解液均为硫酸铜,电极均为铜片:
1、甲烧杯中固定装入浓度 0.8 mol/L 的硫酸铜溶液。
2、乙烧杯中分別装入浓度 0.8 mol/L、0.4 mol/L 、0.2 mol/L、0.1 mol/L、0.05 mol/L、0.025 mol/L 的硫酸铜溶液。
3、使用铜片当电极。测量这六种组合电池的稳定电压及电流,将结果记录于表 1。
㈡实验B:温差电池
电解液均为硫酸铜,电极均为铜片:(步骤略,结果记录于表2)
四、【实验结果】
实验A:浓差电池 :表1
|
甲杯硫酸铜浓度 mol/L |
0.8 |
0.8 |
0.8 |
0.8 |
0.8 |
0.8 |
|
乙杯硫酸铜浓度 mol/L |
0.8 |
0.4 |
0.2 |
0.1 |
0.05 |
0.025 |
|
两杯溶液浓度差值 |
0 |
0.4 |
0.6 |
0.7 |
0.75 |
0.775 |
|
电压 mV |
0 |
6 |
12 |
16 |
22 |
26 |
|
电流 mA |
0 |
0.02 |
0.04 |
0.06 |
0.07 |
0.08 |
实验B:温差电池:表2
|
甲杯硫酸铜温度℃ |
19 |
19 |
19 |
19 |
19 |
19 |
|
乙杯硫酸铜温度℃ |
19 |
29 |
39 |
49 |
59 |
69 |
|
两杯溶液温差℃ |
0 |
10 |
20 |
30 |
40 |
50 |
|
电压 mV |
0 |
6.1 |
12 |
20[来源:] |
27 |
34 |
|
电流 mA |
0 |
0.025 |
0.047 |
0.07 |
0.15 |
0.18 |
五、【讨论】
1、浓差电池:若硫酸铜浓差电池放电较长一段时间后,可观察到甲杯高浓度的溶液颜色逐渐变浅,而乙杯颜色变深,而电压也逐渐下降,同时可观察到甲杯中铜片表面有铜析出。
这说明:甲杯中的电极反应式为
乙杯中的电极反应式为
电池放电一段较长时间后电压下降的原因:
2、温差电池(略)
六、【结论】
由上述【实验结果】可得结论:
实验A: [来源:学&科&网Z&X&X&K]
实验B:(略)
甲、乙两小组同学给你什么启示:
查看习题详情和答案>>