摘要:注意:若用第二幅图则注意伸入试管内导管的长短和塞子.一处错误扣1分.扣完为止 (4)取少量溶液于试管中.滴入几滴KSCN溶液.观察溶液颜色.如果颜色变红.说明溶液中含有Fe3+.否则不含Fe3+?注意:操作1分.现象和结论1分.未答出“取少量溶液于试管中 而直接向滤液中滴加KSCN的扣1分. .如果反应过的还原铁粉混合物中的铁粉过量.铁粉将溶液中的Fe3+全部还原为Fe2+.即便加KSCN溶液也不变红色.反应方程式为Fe+2FeCl3=3FeCl2.注意:三个得分点.结论.方程式.必要的文字解释各1分
网址:http://m.1010jiajiao.com/timu_id_48847[举报]
工业上制氯化铜无水物时,是将浓盐酸用蒸气加热至80℃左右,慢慢加入粗制氧化铜粉(含杂质氧化亚铁和SiO2),充分搅拌后使之溶解,制取流程如下:
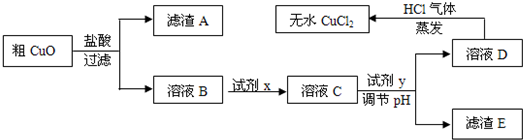
已知:pH≥9.6时,Fe2+以Fe(OH)2的形式完全沉淀;pH≥6.4时,Cu2+以Cu(OH)2的形式完全沉淀;常温时Ksp[Fe(OH)3]=c(Fe3+).c3(OH-)=1.0×10-38.试回答:
(1)根据常温时Fe(OH)3的Ksp计算,当溶液中的Fe3+完全沉淀(此时溶液中的Fe3+物质的量的浓度=10-5mol/L),溶液的pH=
(2)溶液D制取无水CuCl2时,需在HCl气体中蒸干,原因是
(3)粗CuO溶于过量盐酸后,得到的溶液B中加入试剂x将Fe2+氧化为Fe3+,试剂x可以是
A.KMnO4溶液 B.氯水 C.NaClO溶液 D.O3
若用H2O2溶液,则反应的离子方程式为
(4)溶液C加入试剂y,要调整溶液的pH至3-4,试剂y不能是
A.NaOH溶液 B.Cu(OH)2固体 C.Cu2(OH)2CO3固体 D.CuO固体
(5)将ag粗CuO经过以上一系列操作之后,最终得到bg无水CuCl2(不考虑实验过程中操作引起的损耗),下列说法正确的是
A.粗CuO中Cu2+数目小于
B.粗CuO中CuO物质的量小于
mol
C.粗CuO中所含的铜元素的质量分数为
x100%
D.粗CuO中关于CuO的量无法确定.
查看习题详情和答案>>

已知:pH≥9.6时,Fe2+以Fe(OH)2的形式完全沉淀;pH≥6.4时,Cu2+以Cu(OH)2的形式完全沉淀;常温时Ksp[Fe(OH)3]=c(Fe3+).c3(OH-)=1.0×10-38.试回答:
(1)根据常温时Fe(OH)3的Ksp计算,当溶液中的Fe3+完全沉淀(此时溶液中的Fe3+物质的量的浓度=10-5mol/L),溶液的pH=
3
3
.(2)溶液D制取无水CuCl2时,需在HCl气体中蒸干,原因是
HCl抑制CuCl2水解
HCl抑制CuCl2水解
.(3)粗CuO溶于过量盐酸后,得到的溶液B中加入试剂x将Fe2+氧化为Fe3+,试剂x可以是
BD
BD
(填以下选项序号).A.KMnO4溶液 B.氯水 C.NaClO溶液 D.O3
若用H2O2溶液,则反应的离子方程式为
2Fe2++H2O2+2H+=2Fe3++2H2O
2Fe2++H2O2+2H+=2Fe3++2H2O
.(4)溶液C加入试剂y,要调整溶液的pH至3-4,试剂y不能是
A
A
(填以下选项序号),原因是将引入新杂质NaCl
将引入新杂质NaCl
.A.NaOH溶液 B.Cu(OH)2固体 C.Cu2(OH)2CO3固体 D.CuO固体
(5)将ag粗CuO经过以上一系列操作之后,最终得到bg无水CuCl2(不考虑实验过程中操作引起的损耗),下列说法正确的是
ABD
ABD
.(NA表示阿伏伽德罗常数)A.粗CuO中Cu2+数目小于
| aNA |
| 80 |
| b |
| 135 |
C.粗CuO中所含的铜元素的质量分数为
| 64b |
| 135a |
D.粗CuO中关于CuO的量无法确定.
下列有关中和热的说法正确的是( )
| A、表示中和热的热化学方程式:H+(l)+OH-(l)═H2O(l)△H=-57.3 kJ/mol | B、准确测量中和热的实验过程中,至少需测定温度4次 | C、中和热的实验过程中,环形玻璃搅拌棒材料若用铜代替,则测量出的中和热数值偏小 | D、已知2NaOH(aq)+H2SO4(aq)═Na2SO4(aq)+2H2O(l)△H=-114.6 kJ/mol,则该反应的中和热为114.6 kJ/mol |
下列说法正确的是( )
| A、中和热测定实验中,若用铜质搅拌器,则所测中和热的绝对值偏大 | B、用待测液润洗滴定用的锥形瓶,会使滴定结果偏低 | C、滴定终点读取滴定管刻度时,俯视标准液液面,会导致测定结果偏大 | D、配制一定物质的量浓度的溶液,定容时仰视刻度线,会使所配溶液浓度偏低 |
 (2012?丹东模拟)关于如图所示各装置的叙述中,正确的是( )
(2012?丹东模拟)关于如图所示各装置的叙述中,正确的是( )