摘要:24.I.2953KJII.Fe3O4 +4CO2(g) △H=-13 .5 kJ/mol
网址:http://m.1010jiajiao.com/timu_id_453384[举报]
氢是一种理想的绿色清洁能源,氢气的制取与储存是氢能源利用领域的研究热点。利用FeO/Fe3O4循环制氢,已知:
H2O(g)+3FeO(s)  Fe3O4(s)+4H2(g)
△H=akJ/mol (I)
Fe3O4(s)+4H2(g)
△H=akJ/mol (I)
2Fe3O4(s)  6FeO(s)+O2(g) △H=bkJ/mol (II)
6FeO(s)+O2(g) △H=bkJ/mol (II)
下列坐标图分别表示FeO的转化率(图-1 )和一定温度时,H2出生成速率[细颗粒(直径0.25 mm),粗颗粒(直径3 mm)](图-2)。
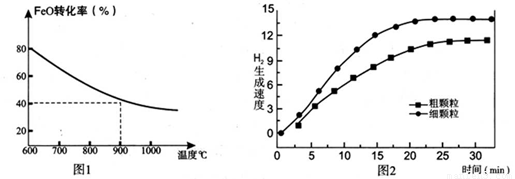
(1)反应:2H2O(g)=2H2(g)+O2(g) △H= (用含a、b代数式表示);
(2)上述反应b>0,要使该制氢方案有实际意义,从能源利用及成本的角度考虑,实现反 应II可采用的方案是: ;
(3)900°C时,在两个体积均为2.0L密闭容器中分别投人0.60molFeO和0.20mol H2O(g)甲容器用细颗粒FeO、乙容器用粗颗粒FeO。
①用细颗粒FeO和粗颗粒FeO时,H2生成速率不同的原因是: ;
②细颗粒FeO时H2O(g)的转化率比用粗颗粒FeO时 H2O(g)的转化率 (填“大”或“小”或“相等”);
③求此温度下该反应的平衡常数K(写出计箅过程,保留两位有效数字)。
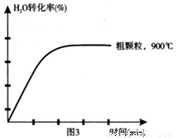
(4)在下列坐标图3中画出在1000°C、用细颗粒FeO时,H2O(g)转化率随时间变化示意图(进行相应的标注)。
查看习题详情和答案>>
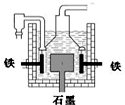 工业上先后用下列方法制备金属钠:
工业上先后用下列方法制备金属钠:①用石墨作电极电解熔融氢氧化钠制钠;
②铁与熔融氢氧化钠作用制钠:3Fe+4NaOH
| ||
③电解熔融氯化钠.
下列有关说法正确的是( )
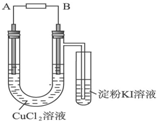 某学生用电解法根据电极上析出物质的质量来验证阿伏加德罗常数值,装置如图所示.
某学生用电解法根据电极上析出物质的质量来验证阿伏加德罗常数值,装置如图所示.(1)A和B为两石墨电极,则B应与直流电源的
正
正
极相连.(2)写出B电极上电极反应式
2Cl--2e-═Cl2↑
2Cl--2e-═Cl2↑
,试管中淀粉KI溶液变化的现象为变蓝色
变蓝色
,相应的离子方程式为Cl2+2I-═I2+2Cl-
Cl2+2I-═I2+2Cl-
.(3)为精确测定电极上析出铜的质量,有下列实验步骤:
①称量电解前电极质量;
②刮下电解后电极上的铜并清洗;
③用蒸馏水清洗电解后电极;
④低温烘干电极称量;
⑤低温烘干刮下的铜称量;
⑥再次低温烘干后称量到恒重.
实验步骤的先后顺序应是
①③④⑥
①③④⑥
.(4)通电电流为I A,通电t s后精确测得铜的质量为m g,已知电子的电量为1.6×10-19C,试写出阿伏加德罗常数的计算表达式:NA=
| 64It |
| 2m×1.6×10-19 |
| 64It |
| 2m×1.6×10-19 |
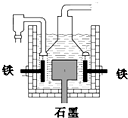 (2013?闸北区二模)早在1807年化学家戴维用电解熔融氢氧化钠制得钠 4NaOH(熔)
(2013?闸北区二模)早在1807年化学家戴维用电解熔融氢氧化钠制得钠 4NaOH(熔)