网址:http://m.1010jiajiao.com/timu_id_4459356[举报]
(14分)孔雀石的主要成分为Cu2(OH)2CO3,还含少量Fe、Si的化合物。实验室以孔雀石为原料制备CuCl2·3H2O及CaCO3的步骤如下:
为解决有关问题,兴趣小组同学查得有关物质沉淀的pH数据如下:
| 物质 | pH (开始沉淀) | pH(完全沉淀) |
| Fe(OH)3 | 1.9 | 3.2 |
| Fe(OH)2 | 7.0 | 9.0 |
| Cu(OH)2 | 4.7 | 6.7 |
⑴“除杂”时先通入足量Cl2将Fe2+氧化成Fe3+,再加入CuO固体调节溶液的pH至 (填写范围)。检验Fe(OH)3是否沉淀完全的实验方案是 。
⑵操作X包括 、 、过滤和洗涤等。CuCl2·3H2O加热灼烧的最终产物的化学式是 。
⑶某种胃药片的治酸剂为CaCO3,该药片中CaCO3质量分数的测定步骤如下:
a.配制0.1mol·L-1的HCl溶液和0.1mol·L-1的NaOH溶液各250mL。
b.取0.1g磨碎后的胃药于锥形瓶中。
c.向锥形瓶内加入25.00mL 0.1 mol·L-1的HCl溶液。
d.以酚酞为指示剂,用0.1mol·L-1的NaOH溶液滴定,至达到滴定终点。
e.重复bcd三步的操作2次。
① 操作c中量取盐酸体积的仪器是 。
② 若洗涤后的碱式滴定管未用NaOH溶液润洗,则所测CaCO3的质量分数将 (选填“偏大”、“偏小”或“无影响”)。
③ 若滴定中NaOH溶液的平均用量为15.00mL,则胃药中碳酸钙的质量分数为 。
查看习题详情和答案>>
(14分)氮化硅(Si3N4)是一种新型陶瓷材料,它可由SiO2与过量焦炭在1300-1700oC的氮气流中反应制得3SiO2(s)+6C(s)+2N2(g) Si3N4(s)+6CO(g)
(1)上述反应氧化剂是 ,已知该反应每转移1mole—,放出132.6kJ的热量,该方程式的∆H = 。
(2)能判断该反应(在体积不变的密闭容器中进行)已经达到平衡状态的是 。
A.焦炭的质量不再变化 B.N2和CO速率之比为1:3
C.生成6molCO同时消耗1mol Si3N4 D.混合气体的密度不再变化
(3)该反应的温度控制在1300-1700oC的原因是 。
(4)某温度下,测得该反应中N2和CO各个时刻的浓度如下,则0—20 min内N2的平均
反应速率 ,在平衡混合气体中CO的体积分数是 。
| 时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 | 35 | 40 | 45 |
| N2浓度 /mol·L-1 | 4.00 | 3.70 | 3.50 | 3.36 | 3.26 | 3.18 | 3.10 | 3.00 | 3.00 | 3.00 |
| CO浓度 /mol·L-1 | 0.00 | 0.90 | 1.50 | 1.92 | 2.22 | 2.46 | 2.70 | — | — | — |
查看习题详情和答案>>
(14分)合成氨对化学工业和国防工业具有重要意义。
(1)向合成塔中按物质的量之比l:4充入N2、H2进行氨的合成,图A为T℃时平衡混合物中氨气的体积分数与压强(p)的关系图。
①图A中氨气的体积分数为15%时,H2的转化率为 。
②图B中T=450℃,则温度为500℃时对应的曲线是 (填“a”或“b”)。
(2)合成氨所需的氢气可由甲烷与水反应制得,反应的热化学方程式为
CH4(g)+H2O(g)  CO(g)+3H2(g) △H>0,一定温度下,在体积为2 L的恒容容器中发生上述反应,各物质的物质的量变化如下表:
CO(g)+3H2(g) △H>0,一定温度下,在体积为2 L的恒容容器中发生上述反应,各物质的物质的量变化如下表: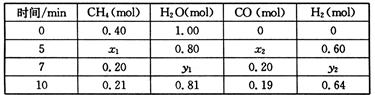
①分析表中数据,判断5 min时反应是否处于平衡状态? (填“是”或“否”),前5 min反应的平均反应速率v(CH4)= 。
②该温度下,上述反应的平衡常数K= 。
③反应在7~10 min内,CO的物质的量减少的原因可能是 (填字母)。
a.减少CH4的物质的量 b.降低温度 c.升高温度 d.充入H2
④若第7分钟时将容器压缩至1L,请在下列坐标系中画出从第7分钟到第11分钟建立新平衡时甲烷浓度随时间的变化曲线。
a
(14 分)过氧化氢和臭氧都是常见的绿色氧化剂,在工业生产中有着重要的用途。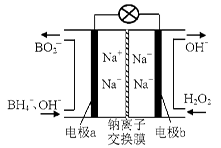
(1)据报道以硼氢化合物NaBH4(B的化合价为+3价)和H2O2作原料的燃料电池,可用作通信卫星电源。负极材料采用Pt/C,正极材料采用MnO2,其工作原理如右图所示。该电池放电时正极的电极反应式为: ;
以MnO2做正极材料,可能是因为 。
(2)火箭发射常以液态肼(N2H4)为燃料,液态过氧化氢
为助燃剂。已知:
N2H4(g) + O2(g) = N2(g) + 2H2O(g) △H =" –" 534 kJ·mol-1
H2O2(l) = H2O(l) + 1/2O2(g) △H =" –" 98.64 kJ·mol-1
H2O(l) = H2O(g) △H=" +" 44kJ·mol-1
则反应N2H4(g) + 2H2O2(l) = N2(g) + 4H2O(g) 的△H= 。
(3)O3 可由臭氧发生器(原理如右图所示)电解稀硫酸制得。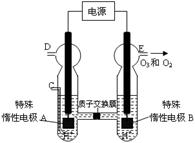
② 图中阴极为 (填“A”或“B”)。
②若C处通入O 2,则A极的电极反应式为: 。
③若C处不通入O 2 ,D、E处分别收集到15.68L和有6.72L气体(标准状况下),则E处收集的气体中O2和O3的体积之比为 (忽略 O 3 的分解)。
(4)新型O3氧化技术对燃煤烟气中的NOx和SO2脱除效果显著,锅炉烟气中的NOx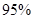 以上是以NO形式存在的,可发生反应NO(g)+ O3 (g)
以上是以NO形式存在的,可发生反应NO(g)+ O3 (g)  NO2(g)+ O2 (g)。在一定条件下,将NO和O3通入绝热恒容密闭容器中发生上述反应 ,正反应速率随时间变化的示意图(如下图)所示。由图可得出的正确说法是
NO2(g)+ O2 (g)。在一定条件下,将NO和O3通入绝热恒容密闭容器中发生上述反应 ,正反应速率随时间变化的示意图(如下图)所示。由图可得出的正确说法是 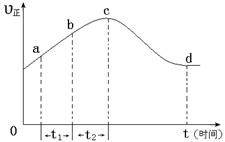
a.反应在c点达到平衡状态
b.反应物浓度:b点小于c点
c.该反应为放热反应
d.Δt1=Δt2时,NO的转化量:a~b段小于b~c段
(14分)孔雀石的主要成分为Cu2(OH)2CO3,还含少量Fe、Si的化合物。实验室以孔雀石为原料制备CuCl2·3H2O及CaCO3的步骤如下:
为解决有关问题,兴趣小组同学查得有关物质沉淀的pH数据如下:
| 物质 | pH (开始沉淀) | pH(完全沉淀) |
| Fe(OH)3 | 1.9 | 3.2 |
| Fe(OH)2 | 7.0 | 9.0 |
| Cu(OH)2 | 4.7 | 6.7 |
⑵操作X包括 、 、过滤和洗涤等。CuCl2·3H2O加热灼烧的最终产物的化学式是 。
⑶某种胃药片的治酸剂为CaCO3,该药片中CaCO3质量分数的测定步骤如下:
a.配制0.1mol·L-1的HCl溶液和0.1mol·L-1的NaOH溶液各250mL。
b.取0.1g磨碎后的胃药于锥形瓶中。
c.向锥形瓶内加入25.00mL 0.1 mol·L-1的HCl溶液。
d.以酚酞为指示剂,用0.1mol·L-1的NaOH溶液滴定,至达到滴定终点。
e.重复bcd三步的操作2次。
①操作c中量取盐酸体积的仪器是 。
②若洗涤后的碱式滴定管未用NaOH溶液润洗,则所测CaCO3的质量分数将 (选填“偏大”、“偏小”或“无影响”)。
③若滴定中NaOH溶液的平均用量为15.00mL,则胃药中碳酸钙的质量分数为 。 查看习题详情和答案>>