摘要:3.(1)Na2CO3溶液 (2)CO2 (3)N a2CO3 + Ca(OH)2 = CaCO3↓ + 2NaOH (该题答案不唯一,只要合理均给分)
网址:http://m.1010jiajiao.com/timu_id_4456519[举报]
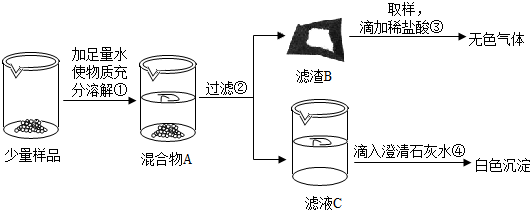
实验室常用的干燥剂“碱石灰”是CaO和NaOH固体的混合物,极易与空气中水蒸气和CO2反应而变质.同学们为确认一瓶久置的“碱石灰”样品的成分,进行如下实验探究.
【猜想】猜想Ⅰ:没有变质,“碱石灰”中只含有CaO、固体NaOH;
猜想Ⅱ:已完全变质,“碱石灰”全部变成了CaCO3和 Na2CO3
【实验】如图所示:实验过程中,同学们还发现向样品中加入足量水溶解时放出大量的热.
【推断判断】
(1)若Ca(OH)2和Na2CO3溶于水无明显的温度变化,则猜想Ⅱ ; (填“成立”或“不成立”)
(2)操作③发生反应的化学方程式为 ;
(3)由操作④的现象判断:滤液C中的溶质一定含有 (写化学式);由此判断猜想Ⅰ (填“成立”或“不成立”)
(4)综合(1)和(2)的结论,判断该样品变质情况为 (填“全部变质”或“部分变质”)
下列对样品成分的分析正确的是 (填序号).
①样品中一定含NaOH ②样品中一定含Na2CO3
③样品中含NaOH、CaO中的一种或两种
【拓展】由上述实验说明,实验室中“碱石灰”应 保存.操作②中玻璃棒的作用是 .
查看习题详情和答案>>
【猜想】猜想Ⅰ:没有变质,“碱石灰”中只含有CaO、固体NaOH;
猜想Ⅱ:已完全变质,“碱石灰”全部变成了CaCO3和 Na2CO3
【实验】如图所示:实验过程中,同学们还发现向样品中加入足量水溶解时放出大量的热.
【推断判断】
(1)若Ca(OH)2和Na2CO3溶于水无明显的温度变化,则猜想Ⅱ
(2)操作③发生反应的化学方程式为
(3)由操作④的现象判断:滤液C中的溶质一定含有
(4)综合(1)和(2)的结论,判断该样品变质情况为
下列对样品成分的分析正确的是
①样品中一定含NaOH ②样品中一定含Na2CO3
③样品中含NaOH、CaO中的一种或两种
【拓展】由上述实验说明,实验室中“碱石灰”应

实验室常用的干燥剂“碱石灰”是CaO和NaOH固体的混合物.同学们为确认一瓶久置的“碱石灰”样品的成分,进行如下实验探究.

查阅资料:1.Ca(OH)2、Na2CO3溶于水无明显的温度变化.
2.CaCl2+Na2CO3=2NaCl+CaCO3↓.
3.CaCl2溶液呈中性.
(1)滤渣B中一定含有
(2)滤液C成分的探究.
[猜想]滤液C中的溶质可能为①NaOH;②Na2CO3;③NaOH和Na2CO3;④
[设计方案并进行实验]甲、乙、丙同学分别设计如下方案并进行探究:
甲同学:取滤液C少许放入试管中,滴加足量的稀盐酸,产生大量无色气体,则滤液C中的溶质是Na2CO3.
乙同学:取滤液C少许放入试管中,滴加足量的无色酚酞,液体变成红色,则滤液C中的溶质一定含有NaOH.
丙同学:取滤液C少许放入试管中,滴加Ca(OH)2溶液,有白色沉淀产生.向上层清液中滴加无色酚酞,无色酚酞变成红色,则滤液C中的溶质是NaOH和Na2CO3.
[反思与评价]
丁同学认真分析上述三位同学的实验,认为他们的结论均有不足之处,并且做出了正确的判断.
他认为滤液C中的溶质一定含有
为进一步确认猜想③正确,请你帮助他设计实验进行验证.
查看习题详情和答案>>

查阅资料:1.Ca(OH)2、Na2CO3溶于水无明显的温度变化.
2.CaCl2+Na2CO3=2NaCl+CaCO3↓.
3.CaCl2溶液呈中性.
(1)滤渣B中一定含有
CaCO3
CaCO3
,产生该物质的化学方程式可能是Ca(OH)2+Na2CO3=CaCO3↓+2NaOH或Ca(OH)2+CO2=CaCO3↓+H2O
Ca(OH)2+Na2CO3=CaCO3↓+2NaOH或Ca(OH)2+CO2=CaCO3↓+H2O
(写出一个即可).(2)滤液C成分的探究.
[猜想]滤液C中的溶质可能为①NaOH;②Na2CO3;③NaOH和Na2CO3;④
NaOH和Ca(OH)2
NaOH和Ca(OH)2
.[设计方案并进行实验]甲、乙、丙同学分别设计如下方案并进行探究:
甲同学:取滤液C少许放入试管中,滴加足量的稀盐酸,产生大量无色气体,则滤液C中的溶质是Na2CO3.
乙同学:取滤液C少许放入试管中,滴加足量的无色酚酞,液体变成红色,则滤液C中的溶质一定含有NaOH.
丙同学:取滤液C少许放入试管中,滴加Ca(OH)2溶液,有白色沉淀产生.向上层清液中滴加无色酚酞,无色酚酞变成红色,则滤液C中的溶质是NaOH和Na2CO3.
[反思与评价]
丁同学认真分析上述三位同学的实验,认为他们的结论均有不足之处,并且做出了正确的判断.
他认为滤液C中的溶质一定含有
Na2CO3
Na2CO3
,可能含有NaOH.为进一步确认猜想③正确,请你帮助他设计实验进行验证.
| 实验操作 | 实验现象 | 实验结论 |
| 猜想③正确 |
(2012?攀枝花)某合作学习小组欲用生石灰制取氢氧化钠固体,他们将少量生石灰放入烧杯中,再向其中加入一定量碳酸钠溶液,充分反应冷却后过滤、洗涤得到固体A和溶液B.请你写出发生反应的化学方程式
请你与小组同学共同完成以下探究:
【查阅资料】NaOH、Ca(OH)2的溶解度
【提出问题1】固体A中的成分是什么?
【猜想与假设1】
甲同学:只有CaCO3
乙同学:CaCO3,Ca(OH)2
乙同学猜想可能含有的Ca(OH)2理由是
【实验与探究】甲、乙同学为了验证各自的猜想,分别进行了实验:
【反思与评价】小组同学讨论后认为,甲同学的实验不能证明他的猜想,理由是
结合甲、乙两同学的实验能证明乙同学的猜想正确,因此小组同学确定了固体A的成分.
【提出问题2】溶液B中溶质的成分是什么?
【猜想与假设2】
丙同学:NaOH,Na2CO3
丁同学:NaOH,Ca(OH)2
戊同学:NaOH
【表达与交流】结合对固体成分的探究,同学们经过讨论确定了丁同学猜想正确,
理由是
该小组同学欲将溶液B加热浓缩,加热不久,溶液出现浑浊,只好停止加热,请解释加热时溶液出现浑浊的原因
该小组同学立即变换方案,向溶液B中继续滴加碳酸钠溶液至不再产生沉淀为止,过滤,再将滤液加热蒸发,冷却结晶,过滤得纯净的氢氧化钠固体.
查看习题详情和答案>>
CaO+H2O=Ca(OH)2、Ca(OH)2+Na2CO3=CaCO3↓+2NaOH;
CaO+H2O=Ca(OH)2、Ca(OH)2+Na2CO3=CaCO3↓+2NaOH;
.请你与小组同学共同完成以下探究:
【查阅资料】NaOH、Ca(OH)2的溶解度
| 温度(℃) | 0 | 20 | 40 | 60 | 80 | 100 |
| NaOH溶解度(g) | 31 | 91 | 111 | 129 | 313 | 336 |
| Ca(OH)2溶解度(g) | 0.19 | 0.17 | 0.14 | 0.12 | 0.09 | 0.08 |
【猜想与假设1】
甲同学:只有CaCO3
乙同学:CaCO3,Ca(OH)2
乙同学猜想可能含有的Ca(OH)2理由是
常温下Ca(OH)2微溶于水,可能会有Ca(OH)2不能溶解
常温下Ca(OH)2微溶于水,可能会有Ca(OH)2不能溶解
.【实验与探究】甲、乙同学为了验证各自的猜想,分别进行了实验:
| 实验内容 | 实验现象 | 实验结论 |
| 甲同学:取少量固体于试管中,再加入稀盐酸. | 有气泡产生 | 自己的猜想正确 |
| 乙同学:取少量固体于试管中,加水充分振荡,过滤,向滤液中滴加 酚酞溶液 酚酞溶液 . |
溶液由无色变为红色 | 自己的猜想正确 |
加入稀盐酸有气泡只能证明有CaCO3,不能证明有无Ca(OH)2
加入稀盐酸有气泡只能证明有CaCO3,不能证明有无Ca(OH)2
;结合甲、乙两同学的实验能证明乙同学的猜想正确,因此小组同学确定了固体A的成分.
【提出问题2】溶液B中溶质的成分是什么?
【猜想与假设2】
丙同学:NaOH,Na2CO3
丁同学:NaOH,Ca(OH)2
戊同学:NaOH
【表达与交流】结合对固体成分的探究,同学们经过讨论确定了丁同学猜想正确,
理由是
溶于水的生成物NaOH一定有,而固体中有Ca(OH)2,说明溶液为Ca(OH)2的饱和溶液[或Ca(OH)2微溶于水],所以一定有Ca(OH)2或固体中有Ca(OH)2即Ca(OH)2过量,所以不会有Na2CO3
溶于水的生成物NaOH一定有,而固体中有Ca(OH)2,说明溶液为Ca(OH)2的饱和溶液[或Ca(OH)2微溶于水],所以一定有Ca(OH)2或固体中有Ca(OH)2即Ca(OH)2过量,所以不会有Na2CO3
.该小组同学欲将溶液B加热浓缩,加热不久,溶液出现浑浊,只好停止加热,请解释加热时溶液出现浑浊的原因
B溶液为Ca(OH)2的饱和溶液,加热,Ca(OH)2的溶解度随温度的升高而降低,故析出Ca(OH)2
B溶液为Ca(OH)2的饱和溶液,加热,Ca(OH)2的溶解度随温度的升高而降低,故析出Ca(OH)2
.该小组同学立即变换方案,向溶液B中继续滴加碳酸钠溶液至不再产生沉淀为止,过滤,再将滤液加热蒸发,冷却结晶,过滤得纯净的氢氧化钠固体.
17、某同学欲检验NaOH粉末中是否混有Na2CO3,他设计了三个实验方案如下:
查看习题详情和答案>>
| 方案 | 结论 | 你对实验方法和结论的评价 | |
| 方案1 | 样品溶于蒸馏水,把pH试纸投入溶液中,若pH大于7 | 混有Na2CO3 | 不行.碳酸钠、氢氧化钠都是碱性的,不能判断 |
| 方案2 | 取少量样品溶于蒸馏水后滴入CuSO4溶液,有蓝色沉淀出现 | 混有Na2CO3 | 不行.因为酸碱中和优先反应,所以硫酸铜和氢氧化钠先反应,而且氢氧化铜和碳酸铜都是蓝色沉淀,不能判断; |
| 方案3 | 取少量样品溶于蒸馏水后滴入足量BaCl2溶液,有白色沉淀 | 混有Na2CO3 | 可行.氯化钡只和碳酸钠反应生成白色沉淀,可以判断 |
(2012?恩施州)CaO和NaOH固体的混合物,俗名“碱石灰”,实验室常用作干燥剂.碱石灰在空气久置会吸收空气中的水和二氧化碳而变质.某实验小组为确定一瓶久置的碱石灰样品的成分,设计了如图所示实验流程. 请你参与探究过程:

(1)为了使样品充分溶解,操作一定还要用到的玻璃仪器是
(2)固体A中一定含有
(3)溶液B成分的探究.
[查阅资料]
①Ca(OH)2、Na2CO3溶于水无明显的温度变化;
②Na2CO3溶液呈碱性,能使酚酞试液变红;
③CaCl2溶液呈中性.
[猜想]
溶液B中溶质可能为:①NaOH; ②Na2CO3; ③NaOH和Na2CO3;④Ca(OH)2和
[设计方案并进行实验]
甲、乙同学分别设计如下方案并进行探究:
甲同学:取少量溶液B于试管中,滴加足量的稀盐酸,产生大量气泡,则溶液B中的溶质是Na2CO3.
乙同学:取少量溶液B于试管中,滴加几滴酚酞试液,溶液变成红色,则溶液B中的溶质一定含有NaOH.
[反思与评价]
丙同学认真分析上述二位同学的实验,认为他们的结论均有不足之处,并且做出了正确的判断.他认为B溶液中一定含有Na2CO3,可能含有NaOH.为进一步确认溶液B中是否含NaOH,做做了如下实验.
实验步骤①中发生的化学反应方程式是
(4)实验过程中,同学们发现向样品中加水时还放出大量的热.综合以上探究,下列对样品成分分析正确的是
A.一定有NaOH B.一定有Na2CO3 C.一定有CaO D.至少有NaOH、CaO中的一种.
查看习题详情和答案>>

(1)为了使样品充分溶解,操作一定还要用到的玻璃仪器是
玻璃棒
玻璃棒
;操作二的名称是过滤
过滤
. (2)固体A中一定含有
碳酸钙(CaCO3)
碳酸钙(CaCO3)
. (3)溶液B成分的探究.
[查阅资料]
①Ca(OH)2、Na2CO3溶于水无明显的温度变化;
②Na2CO3溶液呈碱性,能使酚酞试液变红;
③CaCl2溶液呈中性.
[猜想]
溶液B中溶质可能为:①NaOH; ②Na2CO3; ③NaOH和Na2CO3;④Ca(OH)2和
NaOH
NaOH
[设计方案并进行实验]
甲、乙同学分别设计如下方案并进行探究:
甲同学:取少量溶液B于试管中,滴加足量的稀盐酸,产生大量气泡,则溶液B中的溶质是Na2CO3.
乙同学:取少量溶液B于试管中,滴加几滴酚酞试液,溶液变成红色,则溶液B中的溶质一定含有NaOH.
[反思与评价]
丙同学认真分析上述二位同学的实验,认为他们的结论均有不足之处,并且做出了正确的判断.他认为B溶液中一定含有Na2CO3,可能含有NaOH.为进一步确认溶液B中是否含NaOH,做做了如下实验.
| 实验步骤 | 实验现象 | 实验结论 |
| ①取少量溶液B于试管中,加入足量CaCl2溶液; ②过滤,在滤液中滴加酚酞试液 |
①有白色沉淀生成 ②溶液由无色变为红色 |
猜想③正确 |
CaCl2+Na2CO3=2NaCl+CaCO3↓
CaCl2+Na2CO3=2NaCl+CaCO3↓
,其实验目的是除尽溶液B中的Na2CO3,避免干扰NaOH的检验
除尽溶液B中的Na2CO3,避免干扰NaOH的检验
. (4)实验过程中,同学们发现向样品中加水时还放出大量的热.综合以上探究,下列对样品成分分析正确的是
BD
BD
(填序号). A.一定有NaOH B.一定有Na2CO3 C.一定有CaO D.至少有NaOH、CaO中的一种.