摘要:18.盐酸 Na2CO3+2HCl=2NaCl+H2O+CO2↑
网址:http://m.1010jiajiao.com/timu_id_4456517[举报]
(4分)盐酸既是盐化工的重要产品,又是生产硅材料的重要原料。 右图归纳出了盐酸与其它物质间相互反应的关系(图中“——”表示相连的两种物质能发生反应)。
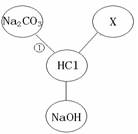
(1)若X是与其它三种不同类别的化合物,则X可以是(填化学 式) 。
(2)根据右图所示物质间关系,写出①反应的化学方程式:
;
查看习题详情和答案>>
(4分)盐酸既是盐化工的重要产品,又是生产硅材料的重要原料。 右图归纳出了盐酸与其它物质间相互反应的关系(图中“——”表示相连的两种物质能发生反应)。

(1)若X是与其它三种不同类别的化合物,则X可以是(填化学 式) 。
(2)根据右图所示物质间关系,写出①反应的化学方程式:
;
查看习题详情和答案>>
(2006?山东)探究影响化学反应速率的因素.
(1)发现和提出问题:
化学反应有的很快,如爆炸,有的相当慢,如铁生锈.决定物质之间能否反应以及化学反应速率快慢的内因是反应物的结构和性质.除此以外,催化剂也能改变化学反应速率.
同学们都有这样的生活经验,木炭在氧气中燃烧比在空气中燃烧的旺;这说明反应物的浓度对化学反应速率有影响.夏天,将食品放在冰箱里不容易腐烂;这说明温度对化学反应速率也有影响.那么,温度和浓度是如何影响化学反应速率?
(2)猜想与假设:a.浓度越大,化学反应的速率越快.
b.温度越高,化学反应的速率越快.
(3)收集证据:
实验仪器和试剂:试管、试管夹、酒精灯、药匙、量筒;锌粒、5%盐酸、20%盐酸.
利用上述实验仪器和试剂进行探究,如果假设是a,你认为需要控制的变量有
如果假设是b,你认为需要控制的变量有
(4)结论与解释:实验证明,条件相同,盐酸的溶质质量分数越大,与金属的反应速率越快.其它条件相同,温度越高,化学反应的速率越快.从反应物的微观粒子相互作用的角度,你认为其原因分别是
(5)交流与反思:通过实验探究我们知道,我们可以通过控制反应条件来控制化学反应的快慢.请你再举出一个通过控制化学反应条件来控制化学反应快慢的事例.
查看习题详情和答案>>
(1)发现和提出问题:
化学反应有的很快,如爆炸,有的相当慢,如铁生锈.决定物质之间能否反应以及化学反应速率快慢的内因是反应物的结构和性质.除此以外,催化剂也能改变化学反应速率.
同学们都有这样的生活经验,木炭在氧气中燃烧比在空气中燃烧的旺;这说明反应物的浓度对化学反应速率有影响.夏天,将食品放在冰箱里不容易腐烂;这说明温度对化学反应速率也有影响.那么,温度和浓度是如何影响化学反应速率?
(2)猜想与假设:a.浓度越大,化学反应的速率越快.
b.温度越高,化学反应的速率越快.
(3)收集证据:
实验仪器和试剂:试管、试管夹、酒精灯、药匙、量筒;锌粒、5%盐酸、20%盐酸.
利用上述实验仪器和试剂进行探究,如果假设是a,你认为需要控制的变量有
温度、锌粒和盐酸的量
温度、锌粒和盐酸的量
.如果假设是b,你认为需要控制的变量有
锌粒的质量、盐酸的浓度和体积
锌粒的质量、盐酸的浓度和体积
.在实验中,通过观测观测气泡产生的速率
观测气泡产生的速率
来判断反应的快慢.(4)结论与解释:实验证明,条件相同,盐酸的溶质质量分数越大,与金属的反应速率越快.其它条件相同,温度越高,化学反应的速率越快.从反应物的微观粒子相互作用的角度,你认为其原因分别是
盐酸的浓度越大,反应物的粒子接触机会就越多,化学反应的速率就快
盐酸的浓度越大,反应物的粒子接触机会就越多,化学反应的速率就快
和温度越高,反应物的粒子运动的速率就越快,反应物的粒子接触机会就越多,化学反应的速率也就越快
温度越高,反应物的粒子运动的速率就越快,反应物的粒子接触机会就越多,化学反应的速率也就越快
.(5)交流与反思:通过实验探究我们知道,我们可以通过控制反应条件来控制化学反应的快慢.请你再举出一个通过控制化学反应条件来控制化学反应快慢的事例.
过氧化氢溶液制氧气需要加入二氧化锰作催化剂
过氧化氢溶液制氧气需要加入二氧化锰作催化剂
.
如图是小明设计的化学动力小车,他在试管中加入两种试剂,塞紧带导管的塞子,将小车放在摩擦力很小的道路上,过一会小车就运动了.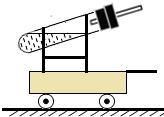
[可用试剂]①镁粉;②铝粉;③铜粉;④10%的稀硫酸;
⑤10%的稀盐酸.(注:10%的稀盐酸比10%的稀硫酸所含
H+浓度要大)
(1)加入的两种试剂总质量相同的条件下,加一次药品能使小车在同一条水平道路上行程最远,应选择的试剂是 (填序号),并且两种试剂使用的量要控制为 ,反应的化学方程式为 .
(2)在加入的两种试剂总质量相同的条件下,要使小车的运动速度比(1)中所选试剂时快,应往试管中加入上述哪两种试剂 (填序号)?你的依据是 .
(3)有的同学根据上述推进原理,但不进行化学反应,也能使小车运动.你猜测他在试管中投入的试剂可能是 .
(4)[继续探究]若仍选用上述提供的试剂,在不改变试剂总质量及小车、道路的条件下,从理论上讲,如何使小车跑的更远? ;
请将改进的方法和理由填写在下表中.(每一种方法奖励2分,本题最多奖励4分,化学卷总分不超过60分.)
1:改进的方法: ;理由: .
2:改进的方法: ;理由: .
查看习题详情和答案>>

[可用试剂]①镁粉;②铝粉;③铜粉;④10%的稀硫酸;
⑤10%的稀盐酸.(注:10%的稀盐酸比10%的稀硫酸所含
H+浓度要大)
(1)加入的两种试剂总质量相同的条件下,加一次药品能使小车在同一条水平道路上行程最远,应选择的试剂是
(2)在加入的两种试剂总质量相同的条件下,要使小车的运动速度比(1)中所选试剂时快,应往试管中加入上述哪两种试剂
(3)有的同学根据上述推进原理,但不进行化学反应,也能使小车运动.你猜测他在试管中投入的试剂可能是
(4)[继续探究]若仍选用上述提供的试剂,在不改变试剂总质量及小车、道路的条件下,从理论上讲,如何使小车跑的更远?
请将改进的方法和理由填写在下表中.(每一种方法奖励2分,本题最多奖励4分,化学卷总分不超过60分.)
| 改进的方法 | 简述理由 | |
| 1 | ||
| 2 |
2:改进的方法:
在古代,人们常用贝壳(主要成分是碳酸钙,杂质不参加反应且不溶于水)和纯碱为原料制取烧碱.某小组同学按题下图所示流程进行实验,请你参与探究并回答相关问题.

(1)贝壳高温锻烧时,发生反应的化学方程式是
(2)操作I中用到的玻璃仪器有烧杯、
(3)溶液蒸发结晶得到固体C的过程中,常用玻璃棒搅拌,其目的是
[问题与发现]该小组同学所得固体C一定是纯净的NaOH吗?
[猜想与假设]根据反应原理,甲、乙、丙三位同学提出以下猜想:
甲:纯净的NaOH 乙:NaOH和Na2CO3的混合物 丙:NaOH和
[探究与验证]甲、乙、丙三位同学分别设计下列方案,对自己的猜想进行验证.实验操作、现象和结论如下表,请参与他们的探究并完成所缺内容.
(注意:若答下列问题奖励4分,化学试卷总分不超过60分.)
[反思与评价]同学们认真研究实验流程,讨论后一致认为
[拓展]请设计实验方案验证实验室久置的氢氧化钠溶液已经部分变质:取该溶液少量放入烧杯中
查看习题详情和答案>>

(1)贝壳高温锻烧时,发生反应的化学方程式是
CaCO3
CaO+CO2↑
| ||
CaCO3
CaO+CO2↑
| ||
(2)操作I中用到的玻璃仪器有烧杯、
漏斗
漏斗
、玻璃棒;(3)溶液蒸发结晶得到固体C的过程中,常用玻璃棒搅拌,其目的是
使溶液体受热均匀,防止液滴外溅
使溶液体受热均匀,防止液滴外溅
;[问题与发现]该小组同学所得固体C一定是纯净的NaOH吗?
[猜想与假设]根据反应原理,甲、乙、丙三位同学提出以下猜想:
甲:纯净的NaOH 乙:NaOH和Na2CO3的混合物 丙:NaOH和
Ca(OH)2
Ca(OH)2
的混合物[探究与验证]甲、乙、丙三位同学分别设计下列方案,对自己的猜想进行验证.实验操作、现象和结论如下表,请参与他们的探究并完成所缺内容.
| 实验操作 | 现象 | 结论 | |
| 甲 | 取少量固体C,溶于适量水形成溶液后,滴加几滴酚酞试液 | 溶液变红 | 猜想成立 |
| 乙 | 取少量固体C,溶于适量水形成溶液后,滴加足量的 稀盐酸 稀盐酸 |
无气泡产生 | 猜想不成立 |
| 丙 | 取少量固体C,溶于适量水形成溶液后,滴加几滴饱和Na2CO3溶液 | 生成白色沉淀 生成白色沉淀 |
猜想成立 |
[反思与评价]同学们认真研究实验流程,讨论后一致认为
甲
甲
同学的实验方案不正确,理由是因为碳酸钠、氢氧化钙的水溶液都显碱性,它们都能够使酚酞试液变红色,所以酚酞试液变红色,不能说明是纯净的氢氧化钠
因为碳酸钠、氢氧化钙的水溶液都显碱性,它们都能够使酚酞试液变红色,所以酚酞试液变红色,不能说明是纯净的氢氧化钠
.[拓展]请设计实验方案验证实验室久置的氢氧化钠溶液已经部分变质:取该溶液少量放入烧杯中
取少量氢氧化钠溶液,向其中滴加适量的氯化钙溶液,观察到有白色沉淀生成,至不再产生沉淀后,取上层清液,向其中滴加酚酞试液,溶液变为红色,综上则说明氢氧化钠变质
取少量氢氧化钠溶液,向其中滴加适量的氯化钙溶液,观察到有白色沉淀生成,至不再产生沉淀后,取上层清液,向其中滴加酚酞试液,溶液变为红色,综上则说明氢氧化钠变质
.