网址:http://m.1010jiajiao.com/timu_id_4453492[举报]
影响电离平衡的因素
外因
①温度:由于电解质的电离是________的,故升高温度,将使弱电解质的电离平衡向________方向移动.
②浓度:在一定温度下,浓度的变化影响电离平衡移动.对于同一弱电解质来说,溶液越稀,离子相互碰撞结合成分子的机会越________,弱电解质的电离程度就越________.因此,稀释溶液会使弱电解质的电离平衡向________方向移动.
③同离子效应:如果加入某种强电解质,其中含有弱电解质的组成离子,会使弱电解质的电离平衡向________方向移动,即加入具有与弱电解质相同离子的强电解质则抑制弱电解质的电离.如向CH3COOH溶液中加入CH3COONa固体,由于CH3COONa完全电离形成________和________,溶液中________浓度增大,使醋酸的电离平衡向________方向移动.
④化学反应:加入能与弱电解质电离出的离子发生反应的物质,则能________弱电解质的电离.如在CH3COOH溶液中加入金属Mg,金属Mg会与CH3COOH电离出的________发生反应而置换出________,使CH3COOH溶液中的________浓度减小,平衡会向________方向移动.
(2)温度:水的电离是
(10分,每空2分)甲、乙两个实验小组利用KMnO4酸性溶液与H2C2O4溶液反应研究影响反应速率的因素。
(1)该反应的离子方程式为(提示:H2C2O4的一级电离平衡常数为5.4×10-2)
。
设计实验方案如下(实验中所用KMnO4溶液均已加入H2SO4):
(2)甲组:通过测定单位时间内生成CO2气体体积的大小来比较化学反应速率的大小。 实验装置如图,实验时分液漏斗中A溶液一次性放下,A、B的成分见下表:
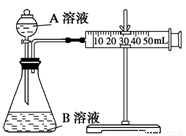
|
序号 |
A溶液 |
B溶液 |
|
① |
2 mL 0.1 mol/L H2C2O4溶液 |
4 mL 0.01 mol/L KMnO4溶液 |
|
② |
2 mL 0.2 mol/L H2C2O4溶液 |
4 mL 0.01 mol/L KMnO4溶液 |
|
③ |
2 mL 0.2 mol/L H2C2O4溶液 |
4 mL 0.01 mol/L KMnO4溶液和少量MnSO4 |
该实验探究的是 对化学反应速率的影响。在反应停止之前,相同时间内针管中所得CO2的体积由大到小的顺序是 (用实验序号填空)。
(3)乙组:通过测定KMnO4溶液褪色所需时间的多少来比较化学反应速率的大小。
取两支试管各加入2 mL 0.1 mol/L H2C2O4溶液,另取两支试管各加入4 mL 0.1 mol/L KMnO4溶液。将四支试管分成两组(各有一支盛有H2C2O4溶液和KMnO4溶液的试管),一组放入冷水中,另一组放入热水中,经过一段时间后,分别混合并振荡,记录溶液褪色所需时间。该实验目的是研究 对化学反应速率的影响,但该组同学始终没有看到溶液褪色,其原因是 。
查看习题详情和答案>>
(10分,每空2分)甲、乙两个实验小组利用KMnO4酸性溶液与H2C2O4溶液反应研究影响反应速率的因素。
(1)该反应的离子方程式为(提示:H2C2O4的一级电离平衡常数为5.4×10-2)

 。
。
设计实验方案如下(实验中所用KMnO4溶液均已加入H2SO4):
(2)甲组:通过测定单位时间内生成CO2气体体积的大小来比较化学反应速率的大小。实验装置如图,实验时分液漏斗中A溶液一次性放下,A、B的成分见下表: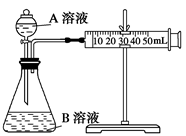
| 序号 | A溶液 | B溶液 |
| ① | 2 mL 0.1 mol/L H2C2O4溶液 | 4 mL 0.01 mol/L KMnO4溶液 |
| ② | 2 mL 0.2 mol/L H2C2O4溶液 | 4 mL 0.01 mol/L KMnO4溶液 |
| ③ | 2 mL 0.2 mol/L H2C2O4溶液 | 4 mL 0.01 mol/L KMnO4溶液和少量MnSO4 |
(3)乙组:通过测定KMnO4溶液褪色所需时间的多少来比较化学反应速率的大小。
取两支试管各加入2 mL 0.1
 mol/L
mol/L H2C2O4溶液,另取两支试管各加入4 mL 0.1 mol/L KMnO4溶液。将四支试管分成两组(各有一支盛有H2C2O4溶液和KMnO4溶液的试管),一组放入冷水中,另一组放入热水中,经过一段时间后,分别混合
H2C2O4溶液,另取两支试管各加入4 mL 0.1 mol/L KMnO4溶液。将四支试管分成两组(各有一支盛有H2C2O4溶液和KMnO4溶液的试管),一组放入冷水中,另一组放入热水中,经过一段时间后,分别混合 并振荡,记录溶液褪色所需时间。该实验目的是研究 对化学反应速率的影响,但该组同学始终没有看到溶液褪色,其原因是 。
查看习题详情和答案>>
并振荡,记录溶液褪色所需时间。该实验目的是研究 对化学反应速率的影响,但该组同学始终没有看到溶液褪色,其原因是 。
查看习题详情和答案>>