摘要:18.在盛有碳酸钠浓溶液的试管中逐滴加入稀盐酸.充分振荡.直到不再产生气体为止.则在此过程中.溶液里离子浓度的变化趋势可能是 A.逐渐增大 B.逐渐减小 C.先逐渐增大.而后逐渐减小 D.先逐渐减小.而后逐渐增大 试用方程式和简要文字表述理由:
网址:http://m.1010jiajiao.com/timu_id_4453481[举报]
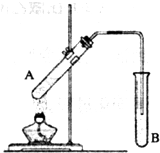 实验室用右图所示装置制取乙酸乙酯.
实验室用右图所示装置制取乙酸乙酯.(1)A试管中加入碎瓷片的目的是
防止液体暴沸
防止液体暴沸
;B试管内盛装的溶液是
饱和碳酸钠溶液
饱和碳酸钠溶液
,其作用有降低乙酸乙酯在水中溶解度,易于分层
降低乙酸乙酯在水中溶解度,易于分层
,吸收随乙酸乙酯挥发出的乙酸,溶解乙酸乙酯中混有的乙醇.
吸收随乙酸乙酯挥发出的乙酸,溶解乙酸乙酯中混有的乙醇.
(2)实验前向B试管中加入一滴酚酞试液,实验过程中观察到溶液的红色逐渐变浅,其原因是
挥发出的乙酸与碳酸钠反应,导致溶液的碱性逐渐减弱
挥发出的乙酸与碳酸钠反应,导致溶液的碱性逐渐减弱
.实验中注意长导管不能伸到B试管液面下,原因是防止B试管中溶液倒吸入A试管中
防止B试管中溶液倒吸入A试管中
删除此空
删除此空
(3)将生成的乙酸乙酯分离出来的实验操作是
分液
分液
,所需要的主要仪器是分液漏斗
分液漏斗
(4)与乙醇和乙酸在浓硫酸催化作用下发生酯化反应相似,某酸和某醇也能发生酯化反应生成酯Cn+3H2n+6O2,若某酸表示为CnH2nO2,则某醇化学式为
C3H8O
C3H8O
.按照如图1所示装置进行有关实验,打开分液漏斗玻璃塞,将A逐滴加入B中.

(1)①若A是浓盐酸,B为二氧化锰,当将A滴入B中时发生反应的离子方程式为
②实验室常用MnO2与浓盐酸共热制取Cl2,也可用KClO3,KMnO4,K2Cr2O7代替MnO2与浓盐酸反应制Cl2.若制取等量的Cl2需浓盐酸最少的是
A.MnO2和浓盐酸反应 B.KClO3和浓盐酸反应 C.KMnO4和浓盐酸反应 D.K2Cr2O7和浓盐酸反应
③在实验室中,要获得干燥纯净的氯气,可以将它通过图2中的装置,其中瓶I中盛放的是
(2)若A是乙醇,B是生石灰,实验中观察到C中黑色固体逐渐变红.当C中黑色固体大部分变红时,关闭F,然后往烧杯中加入热水,静止一会,观察到Ⅲ中试管壁出现了光亮的银镜.则试管E中所发生反应的化学方程式
(3)①若A是能发生银镜反应且只含一个碳的一种液态有机物,B为浓硫酸,E为苯酚钠溶液,C与(2)相同.实验中同样能观察到C中黑色固体逐渐变红,同时可观察到试管E中溶液变浑浊,则A是(写名称)
②写出乙醇和A在浓硫酸存在并加热时所发生的反应方程式
③含有6个碳原子的A的同系物共有
查看习题详情和答案>>

(1)①若A是浓盐酸,B为二氧化锰,当将A滴入B中时发生反应的离子方程式为
MnO2+4H++2 Cl-
Mn2++Cl2↑+2H2O
| ||
MnO2+4H++2 Cl-
Mn2++Cl2↑+2H2O
当实验一段时间后,发现C、D中有红棕色烟,则C的化学式为
| ||
Fe
Fe
②实验室常用MnO2与浓盐酸共热制取Cl2,也可用KClO3,KMnO4,K2Cr2O7代替MnO2与浓盐酸反应制Cl2.若制取等量的Cl2需浓盐酸最少的是
B
B
A.MnO2和浓盐酸反应 B.KClO3和浓盐酸反应 C.KMnO4和浓盐酸反应 D.K2Cr2O7和浓盐酸反应
③在实验室中,要获得干燥纯净的氯气,可以将它通过图2中的装置,其中瓶I中盛放的是
饱和NaCl溶液
饱和NaCl溶液
.(2)若A是乙醇,B是生石灰,实验中观察到C中黑色固体逐渐变红.当C中黑色固体大部分变红时,关闭F,然后往烧杯中加入热水,静止一会,观察到Ⅲ中试管壁出现了光亮的银镜.则试管E中所发生反应的化学方程式
CH3CHO+2Ag(NH3)2OH→CH3COONH4+2Ag↓+3NH3+H2O
CH3CHO+2Ag(NH3)2OH→CH3COONH4+2Ag↓+3NH3+H2O
(3)①若A是能发生银镜反应且只含一个碳的一种液态有机物,B为浓硫酸,E为苯酚钠溶液,C与(2)相同.实验中同样能观察到C中黑色固体逐渐变红,同时可观察到试管E中溶液变浑浊,则A是(写名称)
甲酸
甲酸
.此实验中浓硫酸的作用是脱水剂
脱水剂
.②写出乙醇和A在浓硫酸存在并加热时所发生的反应方程式
HCOOH+C2H5OH
HCOOC2H5+H2O
| 浓硫酸 |
| 加热 |
HCOOH+C2H5OH
HCOOC2H5+H2O
此反应属于| 浓硫酸 |
| 加热 |
取代反应
取代反应
.③含有6个碳原子的A的同系物共有
8种
8种
种.按照如图1所示装置进行有关实验,打开分液漏斗玻璃塞,将A逐滴加入B中.
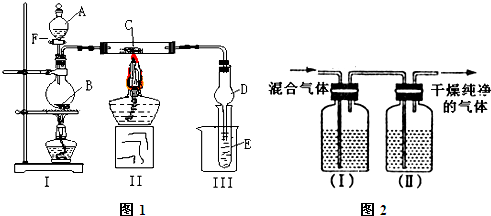
(1)①若A是浓盐酸,B为二氧化锰,当将A滴入B中时发生反应的离子方程式为______ 当实验一段时间后,发现C、D中有红棕色烟,则C的化学式为______
②实验室常用MnO2与浓盐酸共热制取Cl2,也可用KClO3,KMnO4,K2Cr2O7代替MnO2与浓盐酸反应制Cl2.若制取等量的Cl2需浓盐酸最少的是______
A.MnO2和浓盐酸反应 B.KClO3和浓盐酸反应 C.KMnO4和浓盐酸反应 D.K2Cr2O7和浓盐酸反应
③在实验室中,要获得干燥纯净的氯气,可以将它通过图2中的装置,其中瓶I中盛放的是______.
(2)若A是乙醇,B是生石灰,实验中观察到C中黑色固体逐渐变红.当C中黑色固体大部分变红时,关闭F,然后往烧杯中加入热水,静止一会,观察到Ⅲ中试管壁出现了光亮的银镜.则试管E中所发生反应的化学方程式______
(3)①若A是能发生银镜反应且只含一个碳的一种液态有机物,B为浓硫酸,E为苯酚钠溶液,C与(2)相同.实验中同样能观察到C中黑色固体逐渐变红,同时可观察到试管E中溶液变浑浊,则A是(写名称)______.此实验中浓硫酸的作用是______.
②写出乙醇和A在浓硫酸存在并加热时所发生的反应方程式______此反应属于______.
③含有6个碳原子的A的同系物共有______种.
查看习题详情和答案>>
溴乙烷在不同溶剂中与NaOH发生不同类型的反应,生成不同的反应产物.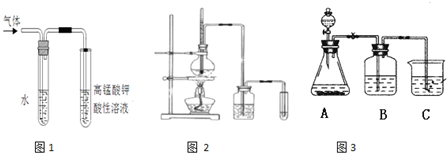
反应类型
(2)写出溴乙烷在NaOH乙醇溶液中的反应方程式
图2是实验室制乙烯并检验其性质的装置图,请回答:
(1)写出圆底烧瓶中反应的方程式
(2)烧瓶中混合液逐渐变黑,并产生某些无机杂质气体,写出产生杂质气体的化学方程式:
(3)为了检验乙烯的生成,试管中应盛放
(4)洗瓶中盛放的试剂为
某学习小组同学为了确定盐酸、苯酚、碳酸的酸性强弱,设计了如图3所示的装置图进行实验:
(1)锥形瓶内装某可溶性盐,写出A中反应的离子方程式:
(2)C中的现象为
(3)B中的试剂为
查看习题详情和答案>>

反应类型
取代
取代
.某同学取少量溴乙烷与NaOH水溶液反应后的混合溶液,向其中滴加AgNO3 溶液,加热,产生少量沉淀.该同学由此得出溴乙烷与NaOH水溶液反应,生成了溴化钠,你认为是否合理,原因:不合理没有用硝酸中和氢氧化钠溶液
不合理没有用硝酸中和氢氧化钠溶液
.(2)写出溴乙烷在NaOH乙醇溶液中的反应方程式
CH2BrCH3+NaOH
CH2=CH2↑+H2O+NaBr
| 醇 |
| 加热 |
CH2BrCH3+NaOH
CH2=CH2↑+H2O+NaBr
反应类型| 醇 |
| 加热 |
消去反应
消去反应
.反应中生成的气体可以用图1所示装置检验,现象是溶液褪色
溶液褪色
,水的作用是吸收乙醇
吸收乙醇
.除高锰酸钾酸性溶液外,还可以用溴的四氯化碳溶液
溴的四氯化碳溶液
检验生成的气体,此时还有必要将气体先通入水中吗?没有
没有
(填“有”或“没有”)图2是实验室制乙烯并检验其性质的装置图,请回答:
(1)写出圆底烧瓶中反应的方程式
CH3CH2OH
CH2=CH2↑+H2O
| 浓H2SO4 |
| 170℃ |
CH3CH2OH
CH2=CH2↑+H2O
,反应类型| 浓H2SO4 |
| 170℃ |
消去反应
消去反应
;(2)烧瓶中混合液逐渐变黑,并产生某些无机杂质气体,写出产生杂质气体的化学方程式:
C+2H2SO4(浓)
CO2↑+2SO2↑+2H2O
| ||
C+2H2SO4(浓)
CO2↑+2SO2↑+2H2O
;
| ||
(3)为了检验乙烯的生成,试管中应盛放
高锰酸钾溶液(或溴的四氯化碳溶液)
高锰酸钾溶液(或溴的四氯化碳溶液)
,现象为溶液褪色
溶液褪色
;(4)洗瓶中盛放的试剂为
氢氧化钠溶液
氢氧化钠溶液
,作用吸收SO2CO2
吸收SO2CO2
某学习小组同学为了确定盐酸、苯酚、碳酸的酸性强弱,设计了如图3所示的装置图进行实验:
(1)锥形瓶内装某可溶性盐,写出A中反应的离子方程式:
CO32-+2H+=H2O+CO2↑
CO32-+2H+=H2O+CO2↑
;(2)C中的现象为
白色浑浊
白色浑浊
,写出C中反应的化学方程式:C6H5ONa+CO2+H2O→C6H5OH+NaHCO3,
C6H5ONa+CO2+H2O→C6H5OH+NaHCO3,
(3)B中的试剂为
饱和碳酸氢钠溶液
饱和碳酸氢钠溶液
,作用吸收CO2中的HCl
吸收CO2中的HCl
.
研究性学习小组进行溴乙烷的制备及性质探究实验。??
探究一:该小组制备溴乙烷的主要步骤如下:?
①向装置图所示的U形管和大烧杯中加入冷水;?
②在小烧杯中按一定比例配制乙醇、水、浓硫酸混合液;?
③向装置图所示的圆底烧瓶中加入一定量研细的溴化钠和少量碎瓷片;?
④将冷却至室温的混合液转移到圆底烧瓶中,加热;
⑤精制溴乙烷。?

回答下列问题:?
(1)步骤②向乙醇和水缓缓加入浓硫酸时,小烧杯要置于冷水中冷却,除了避免硫酸小液滴飞溅外,更主要的目的是___________________。?
(2)步骤④加热片刻后,烧瓶内的混合物会出现橘红色,出现这种现象的原因是(请用化学方程式表示)_____________________________,改用小火加热后,橘红颜色会逐渐消去,消失的原因是(请用化学方程式表示)__________________________________。?
(3)为了更好地控制反应温度,除按图示小火加热,还可采用的加热方式是________________。
(4)步骤⑤反应结束后,将U形管中的混合物倒入分液漏斗中,静置,待液体分层后,弃去(填“上层”或“下层”)_________液体。为了除去粗产品中的杂质,可用下列试剂中的________(填序号)。
A.氢氧化钠稀溶液
B.碳酸钠稀溶液?
C.硝酸银溶液
D.四氯化碳?
探究二:溴乙烷与NaOH乙醇溶液的反应?
学习小组在进行溴乙烷与NaOH乙醇溶液的反应中,观察到有气体生成。?
请你设计两种不同的方法分别检验该气体,并使用下列简易图标,在答题卡的方框中画出这两种方法的实验装置示意图(所给各种图标,使用次数不限,也可以不全部用),并写出装置中所盛试剂的名称(试剂任选)和实验现象。?

