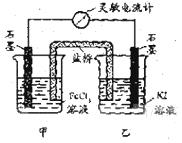
摘要: 控制适合的条件.将反应设计成如右图所示的原电池.下列判断不正确的是 A. 反应开始时.乙中石墨电极上发生氧化反应 B. 反应开始时.甲中石墨电极上Fe3+被还原 C. 电流计读数为零时.反应达到化学平衡状态 D. 电流计读数为零后.在甲中溶入FeCl2固体.乙中石墨电极为负极 [答案]D [解析]乙中I-失去电子放电.发生氧化反应.A正确,由总反应方程式知.Fe3+被还原成Fe2+.B正确,当电流计为零时.说明没有电子发生转移.反应达到平衡.C正确.加入 Fe2+.导致平衡逆向移动.则Fe2+失去电子生成Fe3+.作为负极.D错误. [考点分析]原电池原理综合考查
网址:http://m.1010jiajiao.com/timu_id_4450142[举报]
控制适合的条件,将反应![]() 设计成如右图所示的原电池。下列判断不正确的是
设计成如右图所示的原电池。下列判断不正确的是
![]()
A. 反应开始时,乙中石墨电极上发生氧化反应
![]() B. 反应开始时,甲中石墨电极上Fe3+被还原
B. 反应开始时,甲中石墨电极上Fe3+被还原
![]() C. 电流计读数为零时,反应达到化学平衡状态
C. 电流计读数为零时,反应达到化学平衡状态
![]() D. 电流计读数为零后,在甲中溶入FeCl2固定,乙中石墨电极为负极
D. 电流计读数为零后,在甲中溶入FeCl2固定,乙中石墨电极为负极
控制适合的条件,将反应![]() 设计成如右图所示的原电池。下列判断不正确的是
设计成如右图所示的原电池。下列判断不正确的是
 A. 反应开始时,乙中石墨电极上发生氧化反应
A. 反应开始时,乙中石墨电极上发生氧化反应
B. 反应开始时,甲中石墨电极上Fe3+被还原
C. 电流计读数为零时,反应达到化学平衡状态
D. 电流计读数为零后,在甲中溶入FeCl2固定,乙中石墨电极为负极
查看习题详情和答案>>控制适合的条件,将反应![]() 设计成如右图所示的原电池。下列判断不正确的是
设计成如右图所示的原电池。下列判断不正确的是
![]()
A. 反应开始时,乙中石墨电极上发生氧化反应
![]() B. 反应开始时,甲中石墨电极上Fe3+被还原
B. 反应开始时,甲中石墨电极上Fe3+被还原
![]() C. 电流计读数为零时,反应达到化学平衡状态
C. 电流计读数为零时,反应达到化学平衡状态
![]() D. 电流计读数为零后,在甲中溶入FeCl2固体,乙中石墨电极为负极
D. 电流计读数为零后,在甲中溶入FeCl2固体,乙中石墨电极为负极
 控制适合的条件,将反应
控制适合的条件,将反应