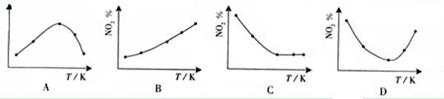
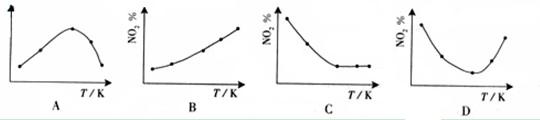
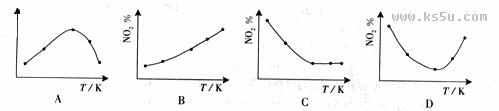
摘要:取五等份NO2 .分别加入温度不同.容积相同的恒容密闭容器中.发生反应: 2NO2(g) N2O4(g).ΔH<0 反应相同时间后.分别测定体系中NO2的百分量(NO2%).并作出其随反应温度(T)变化的关系图.下列示意图中.可能与实验结果相符的是 [答案]BD [解析]在恒容状态下.在五个相同的容器中同时通入等量的NO2.反应相同时间.那么则有两种可能.一是已达到平衡状态.二是还没有达到平衡状态.仍然在向正反应移动.若5个容器在反应相同时间下.均已达到平衡.因为该反应是放热反应.温度越高.平衡向逆反应方向移动.NO2的百分含量随温度升高而升高.所以B正确.若5个容器中有未达到平衡状态的.那么温度越高.反应速率越大.会出现温度高的NO2转化得快.导致NO2的百分含量少的情况.在D图中转折点为平衡状态.转折点左则为未平衡状态.右则为平衡状态.D正确. [考点分析]考查化学反应限度及平衡移动原理及其应用
网址:http://m.1010jiajiao.com/timu_id_4449973[举报]
取五等份NO2,分别加入温度不同、容积相同的恒容密闭容器中,发生反应:2NO2(g)?N2O4(g)△H<0反应相同时间后,分别测定体系中NO2的百分量(NO2%),并作出其随反应温度(T)变化的关系图.下列示意图中,可能与实验结果相符的是( )
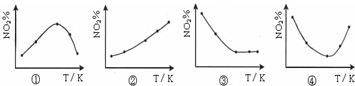

| A、②④ | B、② | C、①② | D、③④ |
取五等份NO2 ,分别加入温度不同、容积相同的恒容密闭容器中,发生反应:
2NO2(g)![]() N2O4(g),ΔH<0 反应相同时间后,分别测定体系中NO2的百分量(NO2%),并作出其随反应温度(T)变化的关系图。下列示意图中,可能与实验结果相符的是
N2O4(g),ΔH<0 反应相同时间后,分别测定体系中NO2的百分量(NO2%),并作出其随反应温度(T)变化的关系图。下列示意图中,可能与实验结果相符的是
![]()

取五等份NO2 ,分别加入温度不同、容积相同的恒容密闭容器中,发生反应:
![]() 2NO2(g)
2NO2(g)![]() N2O4(g),ΔH<0 反应相同时间后,分别测定体系中NO2的百分量(NO2%),并作出其随反应温度(T)变化的关系图。下列示意图中,可能与实验结果相符的是
N2O4(g),ΔH<0 反应相同时间后,分别测定体系中NO2的百分量(NO2%),并作出其随反应温度(T)变化的关系图。下列示意图中,可能与实验结果相符的是
![]()
![]()