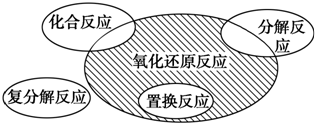
摘要: 氧化还原反应 氧化还原反应与四种基本类型反应之间的关系 化合反应:有单质参加的是氧化还原反应. 分解反应:有单质生成的是氧化还原反应. 置换反应:全部是氧化还原反应. 复分解反应:都是非氧化还原反应. 氧化还原反应的基本类型: (1)自身氧化还原反应:同一种物质的分子内.同种元素或不同种元素的原子之间发生电子转移的氧化还原反应. 说明:自身氧化还原反应中氧化剂和还原剂必须是同一种物质. (2)歧化反应:同一种物质分子内同一种元素同一价态的原子发生电子转移的氧化还原反应.如: C12+2NaOH=2NaCl+NaCl0+H20 3N02+H20=2HN03+NO 说明:①歧化反应是自身氧化还原反应的特例,②歧化反应的特点:某元素的中间价态在适宜条件下同时向较高和较低价态转化. (3)归中反应:同种元素由不同价态转变为中间价态的氧化还原反应.如: 6HCl+KCl03=KCl+3C12↑+3H20 2FeCl3+Fe=3FeCl2 2H2S+S02=3S+2H20 (4)部分氧化还原反应:不同物质之间.部分被氧化或部分被还原的氧化还原反应. Mn02+4HCl(浓)=MnCl2+2H20+C12↑
网址:http://m.1010jiajiao.com/timu_id_4449358[举报]
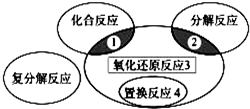 氧化还原反应与四种基本类型反应的关系如图所示,则下列化学反应属于区域3的是( )
氧化还原反应与四种基本类型反应的关系如图所示,则下列化学反应属于区域3的是( ) 氧化还原反应与四种基本反应类型的关系如图所示,则下列化学反应属于
氧化还原反应与四种基本反应类型的关系如图所示,则下列化学反应属于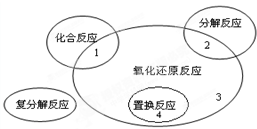
 氧化还原反应与四种基本类型反应的关系如下图所示,则下列化学反应属于图中阴影部分的是( )
氧化还原反应与四种基本类型反应的关系如下图所示,则下列化学反应属于图中阴影部分的是( )