摘要:(青岛市2009年高三模拟练习5月)已知A.B.C.D.E都是周期表中前四周期的元素.它们的核电荷数依次增大.其中A原子核外有三个未成对电子,A与B可形成离子化合物B3A2,C元素是地壳中含量最高的金属元素,D原子核外的M层中有两对成对电子,E原子核外最外层 只有1个电子.其余各层电子均充满.请根据以上信息.回答下列问题:(答题时.A.B.C.D.E用所对应的元素符号表示) (1)E的核外电子排布式是 .A.B.C.D的第一电离能由小到大的顺序为 . (2)B的氯化物的熔点远高于C的氯化物的熔点.理由是 , (3)A的最高价含氧酸根离子中,其中心原子采取 杂化.D的低价氧化物分子的空间构型是 . (4)A.E形成某种化合物的晶胞结构如图所示.则其化学式为 , [解析]A原子核外有三个未成对电子.可以推断为N,A与B可形成离子化合物B3A2.可以推断B为Mg,C元素是地壳中含量最高的金属元素.即为Al,D原子核外的M层中有两对成对电子.可以推断D为S,E原子核外最外层只有1个电子.其余各层电子均充满.可以推断E为Cu. [答案](1)1s22s22p63s23p63d104s1(或[Ar] 3d104s1) Al<Mg< S<N (2)MgCl2为离子晶体而AlCl3为分子晶体 (3)sp2 .V形 (4)Cu3N [考点分析]本题考查核外电子排布式的书写.电离能大小比较.晶体熔点高低比较.中心原子的杂化及分子空间结构.均摊法计算微粒等知识点.
网址:http://m.1010jiajiao.com/timu_id_4449290[举报]
氢核聚变能产生大量的能量,而高纯度铍(Be)是制造核聚变反应装置中最核心的部件之一的屏蔽包的主要材料,据中新网2009年2月6日报道,我国科学家已成功地掌握了获取高纯度铍的技术.下列有关说法不正确的是( )
查看习题详情和答案>>
光导纤维被认为是20世纪最伟大的发明之一.2009年10月6日,瑞典皇家科学院宣布,将2009年诺贝尔物理学奖授予英国华裔科学家高锟,以表彰他在“有关光在纤维中的传输以用于光学通信方面”取得的突破性成就.光导纤维的主要成分是( )
查看习题详情和答案>>
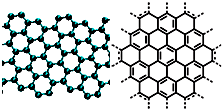 A.美国《科学》杂志评出的2009年十大科学突破之一是石墨烯的研究和应用方面的突破.石墨烯具有原子级的厚度、优异的电学性能、出色的化学稳定性和热力学稳定性.制备石墨烯方法有石墨剥离法、化学气相沉积法等.石墨烯的球棍模型及分子结构示意图如右:
A.美国《科学》杂志评出的2009年十大科学突破之一是石墨烯的研究和应用方面的突破.石墨烯具有原子级的厚度、优异的电学性能、出色的化学稳定性和热力学稳定性.制备石墨烯方法有石墨剥离法、化学气相沉积法等.石墨烯的球棍模型及分子结构示意图如右:(1)下列有关石墨烯说法正确的是
BD
BD
.A.石墨烯的结构与金刚石相似
B.石墨烯分子中所有原子可以处于同一平面
C.12g石墨烯含σ键数为NA
D.从石墨剥离得石墨烯需克服石墨层与层之间的分子间作用
(2)化学气相沉积法是获得大量石墨烯的有效方法之一,催化剂为金、铜、钴等金属或合金,含碳源可以是甲烷、乙炔、苯、乙醇或酞菁等中的一种或任意组合.
①钴原子在基态时,核外电子排布式为:
[Ar]3d74s2
[Ar]3d74s2
.
②乙醇沸点比氯乙烷高,主要原因是
乙醇分子间可形成氢键,而氯乙烷分子间无氢键
乙醇分子间可形成氢键,而氯乙烷分子间无氢键
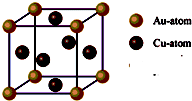
.③右图是金与铜形成的金属互化物合金,它的化学式可表示为:
Cu3Au或AuCu3
Cu3Au或AuCu3
.④含碳源中属于非极性分子的是
a、b、c
a、b、c
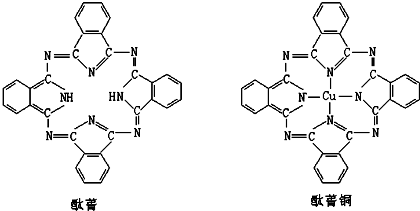
(a.甲烷 b.乙炔 c.苯 d.乙醇)⑤酞菁与酞菁铜染料分子结构如下图,酞菁分子中氮原子采用的杂化方式有:
sp3和sp2
sp3和sp2
;酞菁铜分子中心离子的配位数为:2
2
.
B.硫酸钾是重要的化工产品,生产方法很多,如曼海姆法、石膏两步转化法等.
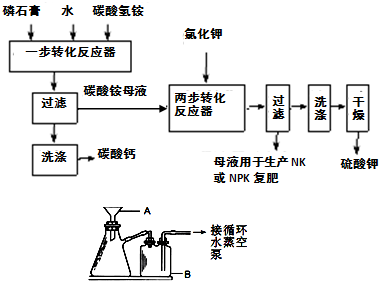
(1)本实验中,采用抽滤方法,图中A、B两仪器名称分别为:
布氏漏斗
布氏漏斗
、安全瓶
安全瓶
.(2)在一部转化反应器中发生的反应为:CaSO4?2H2O+2NH4HCO3=(NH4)2SO4+CaCO3+CO2↑+3H2O,该步反应温度必须低于35℃,其主要目的是
防止NH4HCO3分解
防止NH4HCO3分解
无此空
无此空
.(3)在两步转化反应器中发生反应的化学方程式为
(NH4)2SO4+2KCl=K2SO4+2NH4Cl
(NH4)2SO4+2KCl=K2SO4+2NH4Cl
无此空
无此空
.(4)两步转化反应器中用乙二醇代替水作溶剂,其目的是
降低K2SO4溶解度
降低K2SO4溶解度
有利于K2SO4析出,提高产率
有利于K2SO4析出,提高产率
.(5)磷石膏主要成分为二水硫酸钙(CaSO4?2H2O),还含有未分解的磷矿,未洗涤干净的磷酸、氟化钙、铁铝氧化物等,欲检验母液中含Fe3+,可用亚铁氰化钾溶液检验,该检验反应的离子方程式为:
Fe3++K++[Fe(CN)6]4-=KFe[Fe(CN)6]↓
Fe3++K++[Fe(CN)6]4-=KFe[Fe(CN)6]↓
.(6)该法优点除K2SO4产率高外,再列举一个优点
原料得到充分利用
原料得到充分利用
同时得到副产品化肥等
同时得到副产品化肥等
.2009年10月6日,诺贝尔物理学奖授予“光纤之父”英国华裔科学家高锟以及两位美国科学家威拉德?博伊尔和乔治?史密斯.光导纤维的主要成份是二氧化硅,下列关于二氧化硅的说法正确的是( )
| A、工业上用二氧化硅制取单质硅时,1molC理论上能置换出1molSi | B、6g的二氧化硅中含有0.4NA个共价键 | C、二氧化硅是H2SiO3的酸酐,因此能与碱反应,不能与任何酸反应 | D、由于硅酸比碳酸弱,故二氧化硅不能与碳酸钠反应 |
华裔科学家高琨因“在光纤传输信息领域中的突破性成就”获得2009年诺贝尔物理学奖,下列有关硅材料的说法正确的是( )
| A、光纤的主要成分是高纯度的单质硅 | B、金刚砂的主要成分是二氧化硅 | C、28g硅含有6.02×1023个电子 | D、28Si、29Si、30Si是不同的核素 |