摘要:8.(四川宜宾市第三中学校2009届高三上半期考试理科综合)下列对一些实验事实的理论解释正确的是 选项 实 验 事 实 理 论 解 释 A. SO2溶于水形成的溶液能导电 SO2是电解质 B. 白磷为正四面体分子 白磷分子中P-P间的键角是109°28′ C. 1体积水可以溶解700体积氨气 氨是极性分子且由于有氢键的影响 D. HF的沸点高于HCl H-F的键长比H-Cl的键长短 [解析]A中SO2本身不导电.是非电解质,B中白磷分子中P-P间的键角是60°,D中是由于HF分子间能形成氢键, [答案]C [考点分析]本题考查了键角.氢键.熔沸点影响因素等知识点.
网址:http://m.1010jiajiao.com/timu_id_4449287[举报]
(2009?四川)已知A-O分别代表一种物质,它们之间的转化关系如下图所示(反应条件略去).A、B、H分别是由短周期元素组成的单质.B与冷水缓慢反应,与沸水迅速反应,放出氢气.D是一种离子化合物,其阴阳离子的个数比为2:3,且能与水反就应得到两种碱.C为淡黄色固体化合物,O能与G的水溶液反应生成蓝色沉淀.

请回答下列问题:
(1)组成B单质的元素在周期表位置是
 .
.
(2)J的沸点比硒化氢(H2Se)的沸点高,其原因是
(3)写出I与H在点燃条件下反应生成A和J的化学方程式:
(4)写出N与Cu反应生成L的离子方程式:
(5)上图中,在同一反应里一种物质既作氧化剂,又作还原剂反应共有
查看习题详情和答案>>

请回答下列问题:
(1)组成B单质的元素在周期表位置是
第三周期ⅡA族
第三周期ⅡA族
.化合物C的电子式为

(2)J的沸点比硒化氢(H2Se)的沸点高,其原因是
水分子之间存在氢键且比硒化氢的分子间作用力强
水分子之间存在氢键且比硒化氢的分子间作用力强
.(3)写出I与H在点燃条件下反应生成A和J的化学方程式:
4NH3+3O2
2N2+6H2O.
| ||
4NH3+3O2
2N2+6H2O.
.
| ||
(4)写出N与Cu反应生成L的离子方程式:
3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O
3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O
.(5)上图中,在同一反应里一种物质既作氧化剂,又作还原剂反应共有
2
2
个.(2012?四川)下列框图中的字母分别代表一种常见的物质或其溶液,相互之间的转化关系如下图所示(部分产物及反应条件已略去).已知A、B为气态单质,F是地壳中含量最多的金属元素的单质;E、H、I为氧化物,E为黑色固体,I为红棕色气体;M为红褐色沉淀.

请回答下列问题:
(1)B中所含元素位于周期表中第
(2)A在B中燃烧的现象是
(3)D+E→B的反应中,被氧化与被还原的物质的物质的量比是
(4)G+J→M的离子方程式是
(5)Y受热分解的化学方程式是
查看习题详情和答案>>

请回答下列问题:
(1)B中所含元素位于周期表中第
三
三
周期,ⅦA
ⅦA
族.(2)A在B中燃烧的现象是
气体安静燃烧,火焰呈苍白色,并有白雾产生
气体安静燃烧,火焰呈苍白色,并有白雾产生
.(3)D+E→B的反应中,被氧化与被还原的物质的物质的量比是
2:1
2:1
.(4)G+J→M的离子方程式是
3AlO2-+Fe3++6H2O=3Al(OH)3↓+Fe(OH)3↓
3AlO2-+Fe3++6H2O=3Al(OH)3↓+Fe(OH)3↓
.(5)Y受热分解的化学方程式是
4Fe(NO3)3
2Fe2O3+12NO2↑+3O2↑
| ||
4Fe(NO3)3
2Fe2O3+12NO2↑+3O2↑
.
| ||
(Ⅰ) 如图1,根据下面合成路线完成有关问题:
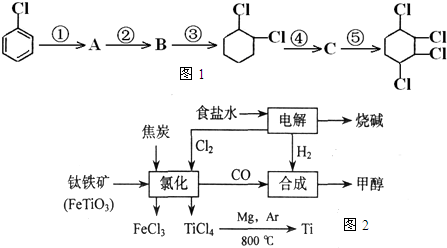
(1)写出B结构简式:B:
 ;
;
(2)第④步反应类型:
(3)A→B的反应试剂及条件:
(Ⅱ) 某烃相对分子质量为106,试求:
(1)该烃的分子式为
(2)该烃如含苯环,则在苯环上的一硝基取代物共有
(Ⅲ) 钛(Ti)被称为继铁、铝之后的第三金属,四川攀枝花和西昌地区的钒钛磁铁矿储量十分丰富.如图2所示,将钛厂、氯碱厂和甲醇厂组成产业链可以大大提高资源利用率,减少环境污染.(钛铁矿中铁元素的化合价为+3价)
请填写下列空白:
(1)电解食盐水时,总反应的离子方程式是
(2)写出合成甲醇的化学方程式
(3)写出钛铁矿经氯化法得到四氯化钛的化学方程式:
查看习题详情和答案>>

(1)写出B结构简式:B:


(2)第④步反应类型:
消去反应
消去反应
;(3)A→B的反应试剂及条件:
NaOH/KOH醇溶液,加热
NaOH/KOH醇溶液,加热
;(Ⅱ) 某烃相对分子质量为106,试求:
(1)该烃的分子式为
C8H10
C8H10
.(2)该烃如含苯环,则在苯环上的一硝基取代物共有
9
9
种.(Ⅲ) 钛(Ti)被称为继铁、铝之后的第三金属,四川攀枝花和西昌地区的钒钛磁铁矿储量十分丰富.如图2所示,将钛厂、氯碱厂和甲醇厂组成产业链可以大大提高资源利用率,减少环境污染.(钛铁矿中铁元素的化合价为+3价)
请填写下列空白:
(1)电解食盐水时,总反应的离子方程式是
2Cl-+2H2O
2OH-+H2↑+Cl2↑
| ||
2Cl-+2H2O
2OH-+H2↑+Cl2↑
;
| ||
(2)写出合成甲醇的化学方程式
CO+2H2
CH3OH
| ||
CO+2H2
CH3OH
;
| ||
(3)写出钛铁矿经氯化法得到四氯化钛的化学方程式:
2FeTiO3 +6C+7Cl2
2TiCl4 +2FeCl3+6CO
| ||
2FeTiO3 +6C+7Cl2
2TiCl4 +2FeCl3+6CO
.
| ||
四川有丰富的天然气资源.某化工厂以天然气为原料合成氨的工艺流程示意图如下:
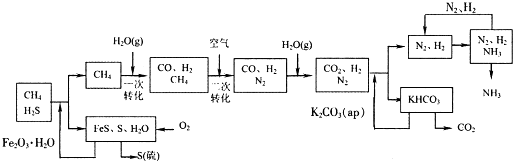
依据上述流程,完成下列填空:
(1)整个流程有三个循环:一是K2CO3(aq)循环,二是N2和H2循环,第三个循环中被循环的物质是
(2)脱硫过程中,若有nmol Fe2O3?H2O转化,则生成S的物质的量为 mol(用含n的代数式表示).
(3)图中CH4的第二次转化过程中发生反应的化学方程式为 .
(4)在合成氨的实际生产过程中,常采取的措施之一是:将生成的氨从混合气体中及时分离出来,并将分离出氨后的氮气和氢气循环利用,同时补充氮气和氢气.请运用化学反应速率和化学平衡的观点说明采取这些措施的理由:
(5)改用过量NaOH溶液吸收天然气中的硫化氢,以石墨作电极电解吸收后所得溶液可回收硫,其电解总反应方程式(忽略氧气的氧化还原)为
(6)若工业生产中以a g氨气和足量的空气为原料(不考虑空气中N2的反应)最大限度的制取NH4NO3,经过一系列转化后,再向反应后的混合物中加入bg水,得到密度为d g/mL的NH4NO3溶液,理论上该溶液中溶质的物质的量浓度可能的最大值为 mol/L.
查看习题详情和答案>>

依据上述流程,完成下列填空:
(1)整个流程有三个循环:一是K2CO3(aq)循环,二是N2和H2循环,第三个循环中被循环的物质是
(2)脱硫过程中,若有nmol Fe2O3?H2O转化,则生成S的物质的量为
(3)图中CH4的第二次转化过程中发生反应的化学方程式为
(4)在合成氨的实际生产过程中,常采取的措施之一是:将生成的氨从混合气体中及时分离出来,并将分离出氨后的氮气和氢气循环利用,同时补充氮气和氢气.请运用化学反应速率和化学平衡的观点说明采取这些措施的理由:
(5)改用过量NaOH溶液吸收天然气中的硫化氢,以石墨作电极电解吸收后所得溶液可回收硫,其电解总反应方程式(忽略氧气的氧化还原)为
(6)若工业生产中以a g氨气和足量的空气为原料(不考虑空气中N2的反应)最大限度的制取NH4NO3,经过一系列转化后,再向反应后的混合物中加入bg水,得到密度为d g/mL的NH4NO3溶液,理论上该溶液中溶质的物质的量浓度可能的最大值为