摘要:7.下列说法正确的是 A . SiH4 比CH4 稳定 B .O2-半径比 F― 的小 C. Na 和 Cs属于第 IA 族元素. Cs 失电子能力比 Na 的强 D . P 和 As属于第 VA 族元素. H3PO4 酸性比 H3 AsO4的弱 [解析]A中由于Si的非金属性小于C.所以SiH4没有CH4 稳定,B中O2-和 F― 的核外电子排布相同.核电荷数越大.离子半径越小,D中同主族元素.自上而下非金属性减弱.所以H3PO4 酸性比 H3 AsO4的强. [答案]C [考点分析]本题主要考查元素周期律的相关知识.
网址:http://m.1010jiajiao.com/timu_id_4449286[举报]
(2008?山东)食盐是日常生活的必需品,也是重要的化工原料.
(1)粗食盐常含有少量K+、Ca2+、Mg2+、Fe3+、SO42-等杂质离子,实验室提纯NaCl的流程如下:
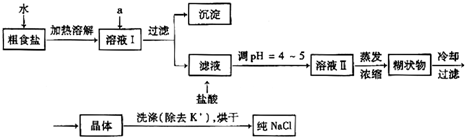
提供的试剂:饱和Na2CO3溶液 饱和K2CO3溶液 NaOH溶液 BaCl2溶液Ba(NO3)2溶液 75%乙醇 四氯化碳
①欲除去溶液I中的Ca2+、Mg2+、Fe3+、SO42-离子,选出a所代表的试剂,按滴加顺序依次为
②洗涤除去NaCl晶体表面附带的少量KCl,选用的试剂为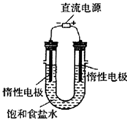
(2)用提纯的NaCl配制500mL4.00mol?L-1NaCl溶液,所用仪器除药匙、玻璃棒外还有
(3)电解饱和食盐水的装置如图所示,若收集的H2为2L,则同样条件下收集的Cl2
(4)实验室制备H2和Cl2通常采用下列反应:
Zn+H2SO4 ZnSO4+H2↑;MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O
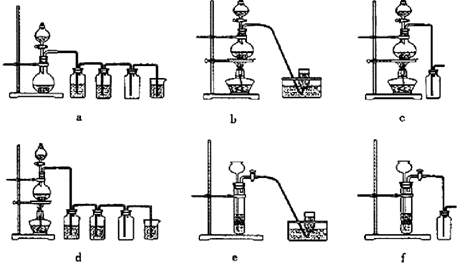
据此,从下列所给仪器装置中选择制备并收集H2的装置
查看习题详情和答案>>
(1)粗食盐常含有少量K+、Ca2+、Mg2+、Fe3+、SO42-等杂质离子,实验室提纯NaCl的流程如下:

提供的试剂:饱和Na2CO3溶液 饱和K2CO3溶液 NaOH溶液 BaCl2溶液Ba(NO3)2溶液 75%乙醇 四氯化碳
①欲除去溶液I中的Ca2+、Mg2+、Fe3+、SO42-离子,选出a所代表的试剂,按滴加顺序依次为
BaCl2、NaOH、Na2CO3
BaCl2、NaOH、Na2CO3
(只填化学式).②洗涤除去NaCl晶体表面附带的少量KCl,选用的试剂为
75%乙醇
75%乙醇
.
(2)用提纯的NaCl配制500mL4.00mol?L-1NaCl溶液,所用仪器除药匙、玻璃棒外还有
天平、烧杯、500mL容量瓶、胶头滴管
天平、烧杯、500mL容量瓶、胶头滴管
(填仪器名称).(3)电解饱和食盐水的装置如图所示,若收集的H2为2L,则同样条件下收集的Cl2
<
<
(填“>”、“=”或“<”)2L,原因是电解生成的氯气与电解生成的NaOH发生了反应
电解生成的氯气与电解生成的NaOH发生了反应
.装置改进后,可用于制备NaOH溶液,若测定溶液中NaOH的浓度,常用的方法是中和滴定
中和滴定
.(4)实验室制备H2和Cl2通常采用下列反应:
Zn+H2SO4 ZnSO4+H2↑;MnO2+4HCl(浓)
| ||
据此,从下列所给仪器装置中选择制备并收集H2的装置
e
e
(填代号)和制备并收集干燥、纯净Cl2的装置d
d
(填代号).可选用制备气体的装置:
 (2008?山东)苯丙酸诺龙是一种兴奋剂,结构简式为:
(2008?山东)苯丙酸诺龙是一种兴奋剂,结构简式为:(I)(1)由苯丙酸诺龙的结构推测,它能
ab
ab
.a.使溴的四氯化碳溶液褪色 b.使酸性KMnO4溶液褪色
c.与银氨溶液发生银镜反应 d.与Na2CO3溶液作用生成CO2
(II)苯丙酸诺龙的一种同分异构体A,在一定条件下可发生下列反应:

提示:已知反应R-CH2-COOH+Cl2
| 红磷 |
| C | ||
|
据以上信息回答(2)~(4)题:
(2)B→D的反应类型是
加成反应
加成反应
.(3)C的结构简式为


(4)F→G的化学方程式是


(2008?山东)北京奥运会“祥云”火炬燃料是丙烷(C3H8),亚特兰大火炬燃料是丙烯(C3H6)
(1)丙烷脱氢可得丙烯.已知:C3H8(g)→CH4(g)+HC≡CH(g)+H2(g)△H1=+156.6kJ?mol-1
CH3CH=CH2(g)→CH4(g)+HC≡CH(g)△H2=+32.4kJ?mol-1 则相同条件下,反应C3H8(g)→CH3CH=CH2(g)+H2(g)的△H=
(2)以丙烷为燃料制作新型燃料电池,电池的正极通入O2,负极通入丙烷,电解质是熔融碳酸盐.电池总反应方程式为
(3)碳氢化合物完全燃烧生成CO2和H2O.常温常压下,空气中的CO2溶于水,达到平衡时,溶液的pH=5.60,c(H2CO3)=1.5×10-5 mol?L-1.若忽略水的电离及H2CO3的第二级电离,则H2CO3 HCO3-+H+的平衡常数K1=
HCO3-+H+的平衡常数K1=
(4)常温下,0.1mol?L-1NaHCO3溶液的pH大于8,则溶液c(H2CO3)
查看习题详情和答案>>
(1)丙烷脱氢可得丙烯.已知:C3H8(g)→CH4(g)+HC≡CH(g)+H2(g)△H1=+156.6kJ?mol-1
CH3CH=CH2(g)→CH4(g)+HC≡CH(g)△H2=+32.4kJ?mol-1 则相同条件下,反应C3H8(g)→CH3CH=CH2(g)+H2(g)的△H=
+124.2
+124.2
kJ?mol-1(2)以丙烷为燃料制作新型燃料电池,电池的正极通入O2,负极通入丙烷,电解质是熔融碳酸盐.电池总反应方程式为
C3H8+5O2═3CO2+4H2O
C3H8+5O2═3CO2+4H2O
;放电时,CO32-移向电池的负
负
(填“正”或“负”)极.(3)碳氢化合物完全燃烧生成CO2和H2O.常温常压下,空气中的CO2溶于水,达到平衡时,溶液的pH=5.60,c(H2CO3)=1.5×10-5 mol?L-1.若忽略水的电离及H2CO3的第二级电离,则H2CO3
 HCO3-+H+的平衡常数K1=
HCO3-+H+的平衡常数K1=4.2×10-7 mol?L-1
4.2×10-7 mol?L-1
.(已知:10-5.60=2.5×10-6)(4)常温下,0.1mol?L-1NaHCO3溶液的pH大于8,则溶液c(H2CO3)
>
>
c(CO32-)(填“>”、“=”或“<”),原因是HCO3- CO32-+H+,HCO3-+H2O
CO32-+H+,HCO3-+H2O H2CO3+OH-,
H2CO3+OH-,
 CO32-+H+,HCO3-+H2O
CO32-+H+,HCO3-+H2O H2CO3+OH-,
H2CO3+OH-,HCO3- CO32-+H+,HCO3-+H2O
CO32-+H+,HCO3-+H2O H2CO3+OH-,
H2CO3+OH-,
(用离子方程式和文字说明) CO32-+H+,HCO3-+H2O
CO32-+H+,HCO3-+H2O H2CO3+OH-,
H2CO3+OH-,