摘要:2课时
网址:http://m.1010jiajiao.com/timu_id_4435122[举报]
时钟反应或振荡反应提供了迷人课堂演示实验,也是一个活跃的研究领域.测定含I-浓度很小的碘化物溶液时,利用振荡反应进行化学放大,以求出原溶液中碘离子的浓度.主要步骤是
①在中性溶液中,用溴将试样中I-氧化成IO3-,将过量的溴除去
②再加入过量的碘化钾,在酸性条件下,使IO3-完全转化成I2
③将②中生成的碘完全萃取后,用肼将其还原成I-,方程式为H2N-NH2+2I2→4I-+N2↑+4H+
④将生成的I-萃取到水层后用①法处理.
⑤将④得到的溶液加入适量的KI溶液,并用硫酸酸化.
⑥将⑤反应后的溶液以淀粉作指示剂,用Na2S2O3标准溶液滴定,方程式为:
2Na2S2O3+I2→Na2S4O6+2NaI
经过上述放大后,则溶液中I-浓度放大为原溶液中I-浓度的(设放大前后溶液体积相等)( )
①在中性溶液中,用溴将试样中I-氧化成IO3-,将过量的溴除去
②再加入过量的碘化钾,在酸性条件下,使IO3-完全转化成I2
③将②中生成的碘完全萃取后,用肼将其还原成I-,方程式为H2N-NH2+2I2→4I-+N2↑+4H+
④将生成的I-萃取到水层后用①法处理.
⑤将④得到的溶液加入适量的KI溶液,并用硫酸酸化.
⑥将⑤反应后的溶液以淀粉作指示剂,用Na2S2O3标准溶液滴定,方程式为:
2Na2S2O3+I2→Na2S4O6+2NaI
经过上述放大后,则溶液中I-浓度放大为原溶液中I-浓度的(设放大前后溶液体积相等)( )
查看习题详情和答案>>
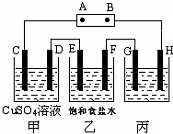 课题式研究性学习是培养学生创造思维的良好方法,某研究性学习小组将下列装置如图连接,C、D、E、F、G、H 都是惰性电极.将电源接通后,向乙中滴入酚酞试液,在F极附近显红色.试回答下列问题:
课题式研究性学习是培养学生创造思维的良好方法,某研究性学习小组将下列装置如图连接,C、D、E、F、G、H 都是惰性电极.将电源接通后,向乙中滴入酚酞试液,在F极附近显红色.试回答下列问题:(1)电源A 极的名称
正极
正极
.(2)甲装置中C极反应式
4OH--4e-=2H2O+O2↑.
4OH--4e-=2H2O+O2↑.
.(3)E极反应式
2Cl--2e-=Cl2↑
2Cl--2e-=Cl2↑
.在C、D、E、F各电极上析出生成物的物质的量比是1:2:2:2.
1:2:2:2.
(4)欲用丙装置精炼粗铜,G应该是
粗铜
粗铜
(填“纯铜”或“粗铜”);欲用丙装置向铁棒上镀铜,H应该是铁
铁
(填“铜”或“铁”),开始G、H两极材料质量相同,电镀一段时间后,两极质量之差为2.56g,则经过电路中电子数目为0.04N A
0.04N A
.课外化学兴趣小组欲测定铜锌合金粉末中锌的质量分数.
Ⅰ.除托盘天平必用外,供选择的实验装置如下: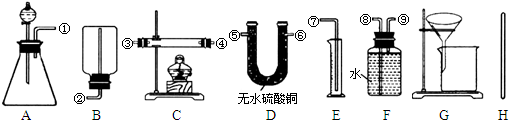
Ⅱ.实验中可测得的数据及其代号如下:
样品的质量m1;充分反应生成的气体体积V(标准状况);反应前仪器和药品的总质量m2;充分反应后仪器和药品的总质量m3;充分反应后剩余固体的质量m4.
(1)实验时必须用到的化学试剂为
(2)甲同学实验中使用了A、E、F三种装置,组装时接口编号的连接顺序为:
×100%
×100%.
(3)乙同学实验中测得的数据为m1和m4,他使用的实验装置有
(4)丙同学实验中只选用了A装置,他要测得的数据有
(5)丁同学设计了另一种测定方法,他考虑使用A、C、D三种装置,在C装置中添加足量CuO.除测定m1外,还准备测定C装置反应前后的质量变化.请评价该方法是否可行并说明理由:
查看习题详情和答案>>
Ⅰ.除托盘天平必用外,供选择的实验装置如下:

Ⅱ.实验中可测得的数据及其代号如下:
样品的质量m1;充分反应生成的气体体积V(标准状况);反应前仪器和药品的总质量m2;充分反应后仪器和药品的总质量m3;充分反应后剩余固体的质量m4.
(1)实验时必须用到的化学试剂为
稀硫酸
稀硫酸
.(2)甲同学实验中使用了A、E、F三种装置,组装时接口编号的连接顺序为:
①⑨⑧⑦
①⑨⑧⑦
.样品中锌的质量分数的计算式为| 65V |
| 22.4m1 |
| 65V |
| 22.4m1 |
(3)乙同学实验中测得的数据为m1和m4,他使用的实验装置有
AGH
AGH
(填字母).(4)丙同学实验中只选用了A装置,他要测得的数据有
m1、m2、m3
m1、m2、m3
(填代号).(5)丁同学设计了另一种测定方法,他考虑使用A、C、D三种装置,在C装置中添加足量CuO.除测定m1外,还准备测定C装置反应前后的质量变化.请评价该方法是否可行并说明理由:
不可行;因为氢气还原氧化铜时,排除装置中的空气及冷却装置都要消耗氢气,而且部分氢气未反应即排出,所以不可能通过计算得出氢气的产量,也无法计算锌的质量
不可行;因为氢气还原氧化铜时,排除装置中的空气及冷却装置都要消耗氢气,而且部分氢气未反应即排出,所以不可能通过计算得出氢气的产量,也无法计算锌的质量
.课外兴趣小组设计图所示装置,用粗铁粒与密度为1.89g?mL-1(质量分数为5%)的硝酸反应制取NO气体.请回答有关问题.
(1)密度为1.89g?mL-1的硝酸的物质的量浓度为
(2)NO气体能用排水法收集,而不能用排空气法收集的可能原因是
(3)当打开止水夹a,关闭止水夹b时,A装置的干燥管中观察到的现象是
(4)完全反应后,A装置烧杯里含铁元素的价态可能是+2价或+3价或+2价和+3价.现有仪器和药品:试管和胶头滴管,0.1mol?L-1KSCN溶液、0.1mol?L-1KI溶液、0.2mol?L-1酸性KMnO4溶液、氯水等.请设计一个简单实验,探究上述判断,填写下列实验报告:
查看习题详情和答案>>

(1)密度为1.89g?mL-1的硝酸的物质的量浓度为
1.5mol/L
1.5mol/L
.(2)NO气体能用排水法收集,而不能用排空气法收集的可能原因是
NO密度与空气接近,且能与空气中氧气反应
NO密度与空气接近,且能与空气中氧气反应
.(3)当打开止水夹a,关闭止水夹b时,A装置的干燥管中观察到的现象是
有无色气体生成,逐渐变为红棕色,同时金属溶解
有无色气体生成,逐渐变为红棕色,同时金属溶解
.当A装置中气体几乎无色时,打开止水夹b,关闭止水夹a,可用C装置收集NO气体.(4)完全反应后,A装置烧杯里含铁元素的价态可能是+2价或+3价或+2价和+3价.现有仪器和药品:试管和胶头滴管,0.1mol?L-1KSCN溶液、0.1mol?L-1KI溶液、0.2mol?L-1酸性KMnO4溶液、氯水等.请设计一个简单实验,探究上述判断,填写下列实验报告:
| 实验步骤 | 操作 | 现象与结论 |
| 第一步 | 取少量液体装于试管,向试管中滴入几滴KSCN溶液 | 溶液变红说明含有Fe3+,溶液不变红色说明不含Fe3+ 溶液变红说明含有Fe3+,溶液不变红色说明不含Fe3+ |
| 第二步 | 取溶液少许于试管内,滴加几滴酸性高锰酸钾溶液. 取溶液少许于试管内,滴加几滴酸性高锰酸钾溶液. |
若溶液紫色褪去,则说明含有Fe2+,若无明显变化,则说明不含Fe2+ |
课堂上同学们对双氧水(H2O2水溶液)做了如下实验探究.
(1)将适量的MnO2加入到5mL 5%的双氧水中,并用带火星的木条试之.观察到的现象是剧烈反应,木条复燃.请写出该实验中H2O2反应的化学方程式:
(2)将双氧水加入酸化的KMnO4溶液中,溶液的紫红色消失,此时双氧水表现出
(3)向含有酚酞的NaOH稀溶液中,逐滴滴入10%的双氧水,红色褪去.
①已知双氧水显弱酸性,试写出H2O2的电离方程式:
②小组讨论红色褪去的原因时,甲同学认为这是由于H2O2是弱酸,消耗了OH-,而使红色褪去.乙同学认为H2O2具有强氧化性,将酚酞氧化,红色消失.请你设计一个简单实验来说明是甲对还是乙对.(简要文字说明)
查看习题详情和答案>>
(1)将适量的MnO2加入到5mL 5%的双氧水中,并用带火星的木条试之.观察到的现象是剧烈反应,木条复燃.请写出该实验中H2O2反应的化学方程式:
2H2O2
2H2O+O2↑
| ||
2H2O2
2H2O+O2↑
.
| ||
(2)将双氧水加入酸化的KMnO4溶液中,溶液的紫红色消失,此时双氧水表现出
还原
还原
性.(3)向含有酚酞的NaOH稀溶液中,逐滴滴入10%的双氧水,红色褪去.
①已知双氧水显弱酸性,试写出H2O2的电离方程式:
H2O2?HO2-+H+
H2O2?HO2-+H+
②小组讨论红色褪去的原因时,甲同学认为这是由于H2O2是弱酸,消耗了OH-,而使红色褪去.乙同学认为H2O2具有强氧化性,将酚酞氧化,红色消失.请你设计一个简单实验来说明是甲对还是乙对.(简要文字说明)
向褪色后的溶液中继续滴加过的NaOH,若出现红色,说明甲同学对,若无明显现象,说明乙同学对
向褪色后的溶液中继续滴加过的NaOH,若出现红色,说明甲同学对,若无明显现象,说明乙同学对
.