网址:http://m.1010jiajiao.com/timu_id_4435091[举报]

(1)实验室若用NH4Cl和熟石灰作试剂来制取、收集干燥的NH3,则需选用上述仪器装置中的
(2)若在A的分液漏斗内改加浓氨水,圆底烧瓶内加NaOH固体,也能制取氨气.请解释装置A中能产生氨气的原因
(3)向浓CaCl2溶液中通入NH3和CO2气制纳米级碳酸钙时,应先通入的气体是

写出制纳米级碳酸钙的化学方程式
(4)试设计简单的实验方案,判断所得碳酸钙样品颗粒是否为纳米级
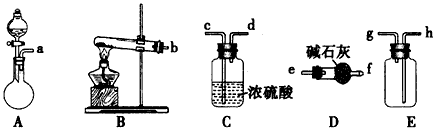
(2)若在A的分液漏斗内改加浓氨水,圆底烧瓶内加NaOH固体,也能制取氨气。请解释装置A中能产生氨气的原因________________。
(3)①向浓CaCl2溶液中通入NH3和CO2制纳米级碳酸钙时,应先通入的气体是________________,若实验过程中有氨气逸出,应选用下列____________装置回收(填代号)。
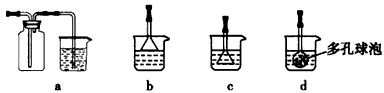
(4)试设计简单的实验方案,判断所得碳酸钙样品颗粒是否为纳米级________________。
实验1氣化亚铜的制取氧化亚铜可用葡萄糖和新制氢氧化铜悬浊液反应制取.文献表明,条件控制不当时会有少量CuO生成.
(1)实验室制取氢氧化铜悬浊液的离子方程式为
(2)实验室用此方法制取并获得少量氧化亚铜固体,需要的玻璃仪器有试管、酒精灯、烧 杯
(3)若要探究该反应发生的最低温度,应选用的加热方式为
实验2测定氣化亚铜的纯度
方案1:称取实验1所得固体m g,采用如下装置进行实验.
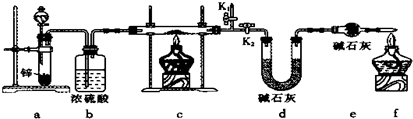
(4)装置a中所加的酸是
(5)通过测出下列物理量,能达到实验目的是
A.反应前后装置a的质量B.装置c充分反应后所得固体的质量
C.反应前后装置d的质量D.反应前后装置e的质量
(6)在氢气验纯后,点燃装置c中酒精灯之前需要对K1、K2进行的操作是
方案2:将实验1所得固体mg溶于足量稀硫酸,经过滤、洗涤、干燥后称出不溶物的质量 (资料:Cu2O+2H+=Cu2++Cu+H2O)
(7)判断经干燥器干燥后的不溶物是否已完全干燥的操作方法是
(8)若实验所得不溶物为
| 9n |
| 4m |
| 9n |
| 4m |
氧化亚铜是大型水面舰船防护涂层的重要原料。某小组进行如下研究,请填写下列空白。
实验1:氧化亚铜的制取氧化亚铜可用葡萄糖和新制氢氧化铜悬浊液反应制取。文献表明,条件控制不当时会有少量CuO生成。
(1)实验室制取氢氧化铜悬浊液的离子方程式为____________。
(2)实验室用此方法制取并获得少量氧化亚铜固体,需要的玻璃仪器有试管、酒精灯、烧杯____________和____________。
(3)若要探究该反应发生的最低温度,应选用的加热方式为____________。
实验2:测定氧化亚铜的纯度
方案1:称取实验1所得固体m g,采用如下装置进行实验。
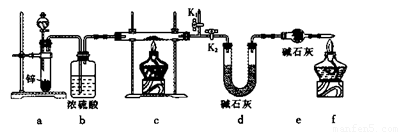
(4)装置a中所加的酸是____________ (填化学式)。
(5)通过测出下列物理量,能达到实验目的的是____________。
A.反应前后装置a的质量
B.装置c充分反应后所得固体的质量
C.反应前后装置d的质量
D.反应前后装置e的质量
(6)在氢气验纯后,点燃装置c中酒精灯之前需要对K1、K2进行的操作是 ____________
方案2:将实验l所得固体mg溶于足量稀硫酸,经过滤、洗涤、干燥后称出不溶物的质量(资料:Cu2O+2H+=Cu2++Cu+H2O)
(7)判断经干燥器干燥后的不溶物是否巳完全干燥的操作方法是__________________________________。
(8)若实验所得不溶物为ng,则该样品中氧化亚铜的质量分数为________________。
查看习题详情和答案>>
某学习小组为探究浓、稀硝酸氧化性的相对强弱,按下图装置进行实验
(夹持仪器已略去).实验表明浓硝酸能将NO氧化成NO2,而稀硝酸不能氧化NO.由此得出的结论是浓硝酸的氧化性强于稀硝酸.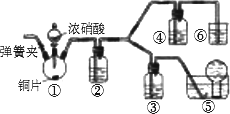
可供选择的药品:浓硝酸、
3 mol/L稀硝酸、蒸馏水、浓硫酸、氢氧化钠溶液、二氧化碳.已知氢氧化钠溶液不与
NO反应,能与NO2反应:2NO2+2NaOH![]() NaNO3+NaNO2+H2O.
NaNO3+NaNO2+H2O.
(1)实验过程中应尽量避免有害气体排放到空气中.装置③、④、⑥中盛放的药品依次是________.
(2)滴加浓硝酸之前要检验装置的气密性,具体的方法是:加入药品,打开弹簧夹后________________.
(3)装置①中发生反应的化学方程式是________________.
(4)装置②的作用是________,发生反应的化学方程式是________.
(5)该小组得出结论所依据的实验现象是________________.
(6)实验结束后,同学们发现装置①中的溶液呈绿色,而不显蓝色.甲同学认为是溶液中硝酸铜的质量分数较高所致,乙同学认为是溶液中溶解了生成的气体所致.为此同学们分别设计了以下4个实验判断上述两种看法是否正确.这些方案中可行的是________(选填字母).
a.加热该绿色溶液,观察颜色变化
b.加水稀释绿色溶液,观察颜色变化
c.向该绿色溶液中通入氮气,观察颜色变化
d.向饱和硝酸铜溶液中通入浓硝酸与铜反应产生的气体,观察颜色变化