网址:http://m.1010jiajiao.com/timu_id_4435089[举报]
我国化学家在“铁基(氟掺杂镨氧铁砷化合物)高温超导”材料研究上取得了重要成果,该研究项目荣获2013年度“国家自然科学奖”一等奖。
(1)基态Fe2+的核外电子排布式为_________________。
(2)氟、氧、砷三种元素中电负性值由大到小的顺序是__________(用相应的元素符号填空)。
(3)Fe(SCN)3溶液中加人NH4F,发生如下反应:Fe(SCN)3+6NH4F=(NH4)3FeF6+3NH4SCN。
①(NH4)3FeF6存在的微粒间作用力除共价键外还有_________(选填序号,下同)。
a.配位键??? b.氢键??? c.金属键??? d.离子键
②已知SCN一中各原子最外层均满足8电子稳定结构,则C原子的杂化方式为_____________,该原子团中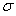 键与
键与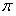 个数的比值为___________________。
个数的比值为___________________。
(4)FeCl3晶体易溶于水、乙醇,用酒精灯加热即可气化,而FeF3晶体熔点高于1000oC,试解释两种化合物熔点差异较大的原因:_______________________________。
(5)氮、磷、砷虽为同主族元素,但其化合物的结构与性质是多样化的。
①该族氢化物RH3(NH3、PH3、AsH3)的某种性质随R的核电荷数的变化趋势如右图所示,则Y轴可表示的氢化物(RH3)性质可能有________。
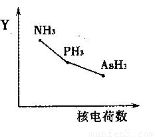
a.稳定性??????? b.沸点?????? c.R—H键能?????? d.分子间作用力
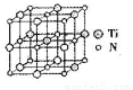
②碳氮化钛化合物在汽车制造和航空航天等领域有广泛的应用,其结构是用碳原子取代氮化钛晶胞(结构如图)顶点的氮原子,据此分析,这种碳氮化钛化台物的化学式为______。
查看习题详情和答案>>
某校化学研究性学习小组在学习了金属的知识后,探究Cu的常见化合物性质.过程如下:
[提出问题]
①在周期表中,Cu、Al位置接近.Cu不如Al活泼,Al(OH)3具有两性,Cu(OH)2也具有两性吗?
②通常情况下,+2价Fe的稳定性小于+3价Fe,+1价Cu的稳定性也小于+2价Cu吗?
③CuO有氧化性,能被H2、CO等还原,也能被NH3还原吗?
[实验方案]
(1)解决问题①需用到的药品有CuSO4溶液、________、________(填试剂名称),同时进行相关实验.
(2)解决问题②的实验步骤和现象如下:取98 g Cu(OH)2固体,加热至80℃~100℃时,得到黑色固体粉末,继续加热到1000℃以上,黑色粉末全部变成红色粉末A.冷却后称量,A的质量为72 g,A的化学式为________.向A中加入适量的稀硫酸,得到蓝色溶液,同时观察到容器中还有红色固体存在.
(3)为解决问题③,设计的实验装置为(夹持及尾气处理装置未画出):
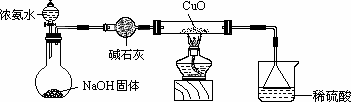
实验中观察到CuO变为红色物质.查资料可知,同时生成一种无污染的气体.该气体的化学式为________.
[实验结论]
(1)Cu(OH)2具有两性.证明Cu(OH)2具有两性的实验现象是________.
(2)根据实验方案(2),得出的+1价Cu和+2价Cu稳定性大小的结论是高温时________;在酸性溶液中________.
(3)CuO能够被NH3还原.
[问题讨论]
有同学认为NH3与CuO反应后生成的红色物质是Cu,也有同学认为NH3与CuO反应后生成的红色物质是Cu和A的混合物.请你设计一个简单的实验检验NH3与CuO反应后生成的红色物质中是否含有A?
________________________
某校化学研究性学习小组在学习了金属的知识后,探究Cu的常见化合物的性质.过程如下:
[提出问题]
①在周期表中,Cu、Al位置接近.Cu不如Al活泼,Al(OH)3具有两性,Cu(OH)2也具有两性吗?
②通常情况下,+2价Fe的稳定性小于+3价Fe,+1价Cu的稳定性也小于+2价Cu吗?
③CuO有氧化性,能被H2、CO等还原,也能被NH3还原吗?
[实验方案]
(1)解决问题①需用到的药品有CuSO4溶液、________、________(填试剂名称),同时进行相关实验.
(2)解决问题②的实验步骤和现象如下:取98 g Cu(OH)2固体,加热至80-100℃时,得到黑色固体粉末,继续加热到1000℃以上,黑色粉末全部变成红色粉末A.冷却后称量,A的质量为72 g,则A的化学式为________.向A中加入适量的稀硫酸,得到蓝色溶液,同时观察到容器中还有红色固体存在.
(3)为解决问题③,设计的实验装置为(夹持及尾气处理装置未画出):
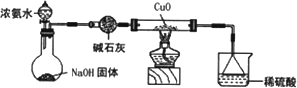
实验中观察到CuO变为红色物质.查资料可知,同时生成一种无污染的气体.
[实验结论]
(1)Cu(OH)2具有两性.证明Cu(OH)2具有两性的实验现象是________.
(2)根据实验方案(2),得出的+1价Cu相+2价Cu稳定性大小的结论是:在高温时________.在酸性溶液中________.
(3)CuO能够被NH3还原.
[问题讨论]
有同学认为NH3与CuO反应后生成的红色物质是Cu,也有同学认为NH3与CuO反应后生成的红色物质是Cu和A的混合物.请你设计一个简单的实验检验NH3与CuO反应后生成的红色物质中是否含有A?
某课外活动小组对一氧化碳还原氧化铁的实验中最后的产物产生浓厚的兴趣,试通过实验来探究其成分。
Ⅰ.实验装置:
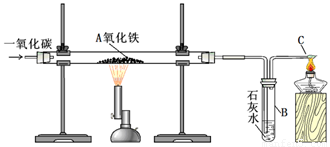
用一氧化碳还原氧化铁的实验装置
该装置B中发生的离子方程式是
装置B的作用是
Ⅱ.实验现象:玻璃管A中的粉末由红色逐渐变为黑色时,停止加热,继续通一氧化碳,冷却到室温,停止通气,同时观察到澄清的石灰水变浑浊。
Ⅲ.实验结论:
甲认为:依据上述实验现象可以判断出生成的黑色固体为金属铁。
乙认为:仅从上述实验现象,不足以证明生成的黑色固体为金属铁,她增加了一个实验:用磁铁靠近生成的黑色固体,看到有黑色固体被磁铁吸引。于是得出生成的黑色固体为金属铁的结论。
请你通过该反应的相关资料对他们结论作出判断并通过实验检验其合理性:
(1)在一定条件下:一氧化碳与氧化铁在加热条件下,可发生如下反应
3Fe2O3+CO 2Fe3O4+CO2
2Fe3O4+CO2
Fe3O4+4CO 4Fe+4CO2
4Fe+4CO2
(2)四氧化三铁(Fe3O4)为黑色固体,有强磁性,能够被磁铁吸引。
甲、乙同学的结论: 你对此评价的理由是:
Ⅳ.实验探究
对反应后固体成分提出假设:
假设1:反应后固体中只有Fe;
假设2:反应后固体中只有Fe3O4;
假设3:反应后固体中__ _____________________
为确定实验中最后的产物的成分,丙同学设计如下实验,请您利用限选试剂和仪器帮助他完成该探究过程,并将答案写在答题卡相应位置。
限选试剂和仪器: 1mol/LCuSO4 、0.01mol/L KSCN溶液、1mol/L盐酸、0.01mol/L氯水、试管、玻璃棒、胶头滴管。
|
实验操作 |
预期现象和结论 |
|
步骤一:取硬质玻璃管中固体产物少量分别于A、B试管中,加入足量1mol/LCuSO4溶液、搅拌溶解。 |
(1)若A试管中黑色固体不溶解,并且没有观察到其他现象,则黑色固体为 (2)若B试管中有红色固体析出,则说明黑色固体中含有Fe。 |
|
步骤二:对试管B中溶液过滤,将所得固体洗涤干净后,加足量1mol/L盐酸后,再依次分别加入适量0.01mol/L氯水、少量0.01mol/L KSCN溶液 |
(1)若溶液不变红色,则
(2)若溶液变红色,则
|
Ⅴ.延伸探究:丁同学试图通过反应前后固体质量的变化来确定黑色固体的成分,你认为可行吗?(假设氧化铁在反应中完全反应) (填“行”或“不行”)理由是 。
查看习题详情和答案>>
某课外活动小组对一氧化碳还原氧化铁的实验中最后的产物产生浓厚的兴趣,试通过实验来探究其成分。
Ⅰ.实验装置:
用一氧化碳还原氧化铁的实验装置
该装置B中发生的离子方程式是
装置B的作用是
Ⅱ.实验现象:玻璃管A中的粉末由红色逐渐变为黑色时,停止加热,继续通一氧化碳,冷却到室温,停止通气,同时观察到澄清的石灰水变浑浊。
Ⅲ.实验结论:
甲认为:依据上述实验现象可以判断出生成的黑色固体为金属铁。
乙认为:仅从上述实验现象,不足以证明生成的黑色固体为金属铁,她增加了一个实验:用磁铁靠近生成的黑色固体,看到有黑色固体被磁铁吸引。于是得出生成的黑色固体为金属铁的结论。
请你通过该反应的相关资料对他们结论作出判断并通过实验检验其合理性:
(1)在一定条件下:一氧化碳与氧化铁在加热条件下,可发生如下反应
3Fe2O3+CO 2Fe3O4+CO2
2Fe3O4+CO2
Fe3O4+4CO 4Fe+4CO2
4Fe+4CO2
(2)四氧化三铁(Fe3O4)为黑色固体,有强磁性,能够被磁铁吸引。
甲、乙同学的结论: 你对此评价的理由是:
Ⅳ.实验探究
对反应后固体成分提出假设:
假设1:反应后固体中只有Fe;
假设2:反应后固体中只有Fe3O4;
假设3:反应后固体中_______________________
为确定实验中最后的产物的成分,丙同学设计如下实验,请您利用限选试剂和仪器帮助他完成该探究过程,并将答案写在答题卡相应位置。
限选试剂和仪器: 1mol/LCuSO4 、0.01mol/L KSCN溶液、1mol/L盐酸、0.01mol/L氯水、试管、玻璃棒、胶头滴管。
| 实验操作 | 预期现象和结论 |
| 步骤一:取硬质玻璃管中固体产物少量分别于A、B试管中,加入足量1mol/LCuSO4溶液、搅拌溶解。 | (1)若A试管中黑色固体不溶解,并且没有观察到其他现象,则黑色固体为 (2)若B试管中有红色固体析出,则说明黑色固体中含有Fe。 |
| 步骤二:对试管B中溶液过滤,将所得固体洗涤干净后,加足量1mol/L盐酸后,再依次分别加入适量0.01mol/L氯水、少量0.01mol/L KSCN溶液 | (1)若溶液不变红色,则 (2)若溶液变红色,则 |
Ⅴ.延伸探究:丁同学试图通过反应前后固体质量的变化来确定黑色固体的成分,你认为可行吗?(假设氧化铁在反应中完全反应) (填“行”或“不行”)理由是 。 查看习题详情和答案>>