摘要:传统的练习(略)
网址:http://m.1010jiajiao.com/timu_id_4434894[举报]
全球领先的化工公司巴斯夫为上海世博提供可持续建材. 采用巴斯夫创新的隔热保温解决方案Neopor制成的板材与传统的EPS(可发性聚苯乙烯( ))板相比,因为含有红外吸收成分,由Neopor制成的保温板可以将保温效率提高20%.下列有关说法不正确的是( )
))板相比,因为含有红外吸收成分,由Neopor制成的保温板可以将保温效率提高20%.下列有关说法不正确的是( )
 ))板相比,因为含有红外吸收成分,由Neopor制成的保温板可以将保温效率提高20%.下列有关说法不正确的是( )
))板相比,因为含有红外吸收成分,由Neopor制成的保温板可以将保温效率提高20%.下列有关说法不正确的是( )
查看习题详情和答案>>
钛冶炼厂与氯碱厂、甲醇厂组成一个产业链(如图所示),将大大提高资源的利用率,减少环境污染.
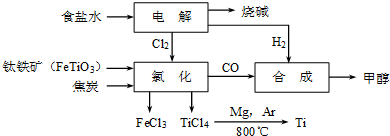
请回答下列问题:
(1)Ti的原子序数为22,Ti位于元素周期表中第 周期,第 族.
(2)写出钛铁矿在高温下与焦炭经氯化得到四氯化钛的化学方程式 .
(3)制备TiO2的方法之一是利用TiCl4水解生成TiO2?x H2O,再经焙烧制得.水解时需加入大量的水并加热,请结合化学方程式和必要的文字说明原因:
(4)由TiCl4→Ti 需要在Ar气中进行的理由是 .反应后得到Mg、MgCl2、Ti的混合物,可采用真空蒸馏的方法分离得到Ti,依据下表信息,需加热的温度略高于 ℃即可.
(5)用氧化还原滴定法测定TiO2的质量分数:一定条件下,将TiO2溶解并还原为Ti3+,再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+.滴定分析时,称取TiO2(摩尔质量为M g/mol)试样w g,消耗c mol/L NH4Fe(SO4)2标准溶液V mL,则TiO2质量分数为 .(用代数式表示)
(6)由CO和H2合成甲醇的方程式是:CO(g)+2H2(g)?CH3OH(g).若不考虑生产过 程中物质的任何损失,上述产业链中每合成6mol甲醇,至少需额外补充H2 mol.
查看习题详情和答案>>

请回答下列问题:
(1)Ti的原子序数为22,Ti位于元素周期表中第
(2)写出钛铁矿在高温下与焦炭经氯化得到四氯化钛的化学方程式
(3)制备TiO2的方法之一是利用TiCl4水解生成TiO2?x H2O,再经焙烧制得.水解时需加入大量的水并加热,请结合化学方程式和必要的文字说明原因:
(4)由TiCl4→Ti 需要在Ar气中进行的理由是
| TiCl4 | Mg | MgCl2 | Ti | |
| 熔点/℃ | -25.0 | 648.8 | 714 | 1667 |
| 沸点/℃ | 136.4 | 1090 | 1412 | 3287 |
(6)由CO和H2合成甲醇的方程式是:CO(g)+2H2(g)?CH3OH(g).若不考虑生产过 程中物质的任何损失,上述产业链中每合成6mol甲醇,至少需额外补充H2
(2012?南京二模)氨是最重要的化工产品之一.
(1)合成氨用的氢气可以甲烷为原料帛制得.有关化学反应的能量变化如下图所示,则CH4(g)与H2O(g)反应生成CO(g)和H2(g)的热化学方程式为

(2)近年有人将电磁场直接加在氮气与氢气反应的容器内,在较低的温度和压强条件下合成氨,获得了较好的产率.从化学反应本质角度分析,电磁场对合成氨反应的作用是
(3)直接供氨式碱性燃料电池的电池反应为:4NH3+3O2═2N2+6H2O,负极电极反应式为:
(4)氨气制取尿素[CO(NH2)2]的合成塔中发生反应:2NH3(g)+CO2(g)?CO(NH2)2(l)+H2O(g).图4为合成塔中不同氨碳比a[n(NH3)/n(CO2)]和水碳比b[n(H2O)/n(CO2)]时二氧化碳转化率(x).b宜控制在
(5)氨氧化法制硝酸工业中,可用尿素溶液除去尾气中氮氧化物(NO和NO2).尾气中的NO、NO2与水反应生成亚硝酸,亚硝酸再与尿素反应生成对大气无污染的气体.1mol尿素能吸收工业尾气中氮氧化物(假设NO、NO2体积比为1:1)的质量为
查看习题详情和答案>>
(1)合成氨用的氢气可以甲烷为原料帛制得.有关化学反应的能量变化如下图所示,则CH4(g)与H2O(g)反应生成CO(g)和H2(g)的热化学方程式为
CH4(g)+H2O(g)═CO(g)+3H2(g)△H=+161.1kJ?mol-1
CH4(g)+H2O(g)═CO(g)+3H2(g)△H=+161.1kJ?mol-1
.
(2)近年有人将电磁场直接加在氮气与氢气反应的容器内,在较低的温度和压强条件下合成氨,获得了较好的产率.从化学反应本质角度分析,电磁场对合成氨反应的作用是
在电磁场的作用下氮氮三键更容易断裂,降低了反应所需要的能量,反应更容易进行
在电磁场的作用下氮氮三键更容易断裂,降低了反应所需要的能量,反应更容易进行
;与传统的合成氨的方法比较,该方法的优点是节约了能源、降低了对设备的要求
节约了能源、降低了对设备的要求
.(3)直接供氨式碱性燃料电池的电池反应为:4NH3+3O2═2N2+6H2O,负极电极反应式为:
2NH3-6e-+6OH-=N2+6H2O
2NH3-6e-+6OH-=N2+6H2O
.(4)氨气制取尿素[CO(NH2)2]的合成塔中发生反应:2NH3(g)+CO2(g)?CO(NH2)2(l)+H2O(g).图4为合成塔中不同氨碳比a[n(NH3)/n(CO2)]和水碳比b[n(H2O)/n(CO2)]时二氧化碳转化率(x).b宜控制在
A
A
(填序号)范围内(A.0.6~0.7 B.1~1.1 C.1.5~1.61);a宜控制在4.0左右,理由是氨碳比a[n(NH3)/n(CO2)]大于4.0时,增大氨气的物质的量,二氧化碳的转化率增加不大,增加了生产成本;氨碳比a[n(NH3)/n(CO2)]小于4.0时,二氧化碳的转化率较小,
氨碳比a[n(NH3)/n(CO2)]大于4.0时,增大氨气的物质的量,二氧化碳的转化率增加不大,增加了生产成本;氨碳比a[n(NH3)/n(CO2)]小于4.0时,二氧化碳的转化率较小,
.(5)氨氧化法制硝酸工业中,可用尿素溶液除去尾气中氮氧化物(NO和NO2).尾气中的NO、NO2与水反应生成亚硝酸,亚硝酸再与尿素反应生成对大气无污染的气体.1mol尿素能吸收工业尾气中氮氧化物(假设NO、NO2体积比为1:1)的质量为
76
76
g.