摘要:2.下列氧化还原反应中.同一元素既被氧化又被还原的是 A.2NO+O2=2NO2 B.N2+O2=2NO C.N2+3H2=2NH3 D.3NO2+H2O=2HNO3+NO
网址:http://m.1010jiajiao.com/timu_id_4432630[举报]
下列氧化还原反应中,同一元素既被氧化又被还原的是( )
A.2NO+O2====2NO2 B.N2+O2====2NO
C.N2+3H2====2NH3 D.3NO2+H2O====2HNO3+NO
查看习题详情和答案>>下列氧化还原反应中,同一元素既被氧化又被还原的是
- A.2NO+O2====2NO2
- B.N2+O2====2NO
- C.N2+3H2====2NH3
- D.3NO2+H2O====2HNO3+NO
下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,回答下列问题: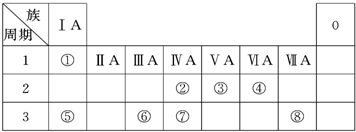
(1)地壳中含量居于第二位的元素在周期表中的位置是
(2)②、⑦的最高价含氧酸的酸性是由强到弱的,用原子结构解释原因:
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含共价键的离子化合物,写出其中一种化合物的电子式
 .
.
(4)由表中两种元素的原子按1:1组成的常见液态化合物的稀溶液易被催化分解,下列物质不能做该反应催化剂的是(填序号)
a.MnO2 b.CuSO4 c.Na2SO3 d.FeCl3
(5)W与④是相邻的同主族元素.在下表中列出H2WO3的各种不同化学性质,举例并写出相应的化学方程式.
(6)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应(如图):
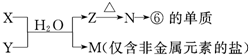
X溶液与Y溶液反应的离子方程式
N→⑥的单质的化学方程式为
M溶液中离子浓度由大到小的排列顺序是
M中阳离子的鉴定方法
查看习题详情和答案>>

(1)地壳中含量居于第二位的元素在周期表中的位置是
第三周期第IVA族
第三周期第IVA族
.(2)②、⑦的最高价含氧酸的酸性是由强到弱的,用原子结构解释原因:
同一主族元素从上到下原子核外电子层数依次增多
同一主族元素从上到下原子核外电子层数依次增多
,原子半径逐渐增大,得电子能力逐渐减弱,非金属性逐渐减弱.(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含共价键的离子化合物,写出其中一种化合物的电子式


(4)由表中两种元素的原子按1:1组成的常见液态化合物的稀溶液易被催化分解,下列物质不能做该反应催化剂的是(填序号)
c
c
.a.MnO2 b.CuSO4 c.Na2SO3 d.FeCl3
(5)W与④是相邻的同主族元素.在下表中列出H2WO3的各种不同化学性质,举例并写出相应的化学方程式.
| 编号 | 性质 | 化学方程式 |
| 示例 | 氧化性 | H2WO3+3H3PO3═3H3PO4+H2W↑ |
| 1 | 还原性 还原性 |
H2SO3+Br2+2H2O=H2SO3+2HBr H2SO3+Br2+2H2O=H2SO3+2HBr |
| 2 | 酸性 酸性 |
H2SO3+2NaOH=Na2SO3+2H2O H2SO3+2NaOH=Na2SO3+2H2O |

X溶液与Y溶液反应的离子方程式
Al3++3NH3+3H2O=Al(OH)3↓+3NH4+
Al3++3NH3+3H2O=Al(OH)3↓+3NH4+
,N→⑥的单质的化学方程式为
2Al2O3(熔融)
4Al+3O2↑
| ||
| 冰晶石 |
2Al2O3(熔融)
4Al+3O2↑
,
| ||
| 冰晶石 |
M溶液中离子浓度由大到小的排列顺序是
c(Cl-)>c(NH4+)>c(H+)>c(OH-)或c(NO3-)>c(NH4+)>c(H+)>c(OH-)
c(Cl-)>c(NH4+)>c(H+)>c(OH-)或c(NO3-)>c(NH4+)>c(H+)>c(OH-)
,M中阳离子的鉴定方法
取少量M样品放入试管,加入氢氧化钠溶液,加热,产生能使湿润的红色石蕊试纸变蓝的气体,证明有铵根离子
取少量M样品放入试管,加入氢氧化钠溶液,加热,产生能使湿润的红色石蕊试纸变蓝的气体,证明有铵根离子
.