摘要:5.设NA为阿伏加德罗常数.下列说法正确的是( ) A.0.1mol Fe与0.1mol Cl2充分反应.转移的电子数为0.3NA B.1mol H2O2完全分解生成H2O和O2时.转移了NA个电子 C.1mol C10H22分子中.含有共价键数目为32NA D.0.5mol Na2O2中含有NA个阴离子 [解析]Fe与Cl2反应生成FeCl3.Fe过量.转移电子数小于0.3NA.A项不正确,H2O2完全分解时.是1mol负1价氧失电子.另外1mol负1价得电子.转移电子为1mol.B项正确,1mol C10H22分子中含共价键数目为NA.即31NA.C项不正确,0.5mol Na2O2含有0.5NA个O2-2. [答案]B.
网址:http://m.1010jiajiao.com/timu_id_4426321[举报]
(2009?宿迁模拟)工业合成氨与制备硝酸一般可连续生产,流程如图1:

在800℃、铂催化剂存在条件下,氨与氧气反应的主要产物是NO 和H2O.在实际生产中氨的氧化率与混合气中氧氨比(氧气与氨气物质的量比,以γ{n(O2)/n(NH3)}表示)的关系如图2所示.
请回答下列各题:
(1)若氨氧化率达到100%,理论上γ{n(O2)/n (NH3)}为1.25,而实际生产要将γ值维持在1.7~2.2之间,其原因是
(2)若使氨的氧化率达到95%,应控制氨在氨、空气混合气体中的体积分数约为
(设氧气占空气的体积分数为20%).将γ=1.75的氨、空气混合气体通入800℃、盛有铂催化剂的氧化炉,充分反应后导入到吸收塔的气体的主要成分是
(3)现以a mol NH3和足量空气为原料(不考虑N2的反应)最大程度制取NH4NO3,经过一系列转化反应后,向反应后的混合物中加入b g水,得到密度为ρ g?mL-1的溶液,计算该溶液中NH4NO3物质的量浓度可能的最大值
mol?L-1
mol?L-1.
查看习题详情和答案>>

在800℃、铂催化剂存在条件下,氨与氧气反应的主要产物是NO 和H2O.在实际生产中氨的氧化率与混合气中氧氨比(氧气与氨气物质的量比,以γ{n(O2)/n(NH3)}表示)的关系如图2所示.
请回答下列各题:
(1)若氨氧化率达到100%,理论上γ{n(O2)/n (NH3)}为1.25,而实际生产要将γ值维持在1.7~2.2之间,其原因是
一方面提高氧气量,增大氨的氧化率;另方面γ值在该范围,氨的氧化率已高达95~99%,再提高,氨的氧化率上升空间已有限,反而会增加能耗,提高生产成本
一方面提高氧气量,增大氨的氧化率;另方面γ值在该范围,氨的氧化率已高达95~99%,再提高,氨的氧化率上升空间已有限,反而会增加能耗,提高生产成本
.(2)若使氨的氧化率达到95%,应控制氨在氨、空气混合气体中的体积分数约为
10.5%
10.5%
(设氧气占空气的体积分数为20%).将γ=1.75的氨、空气混合气体通入800℃、盛有铂催化剂的氧化炉,充分反应后导入到吸收塔的气体的主要成分是
N2、NO2、H2O
N2、NO2、H2O
.(3)现以a mol NH3和足量空气为原料(不考虑N2的反应)最大程度制取NH4NO3,经过一系列转化反应后,向反应后的混合物中加入b g水,得到密度为ρ g?mL-1的溶液,计算该溶液中NH4NO3物质的量浓度可能的最大值
| 500aρ |
| 49a+b |
| 500aρ |
| 49a+b |
(2009?宿迁模拟)某制药厂用两种石油裂解气C4H8和C2H4以及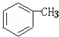 合成一种药物K,其合成路线设计如下:
合成一种药物K,其合成路线设计如下:
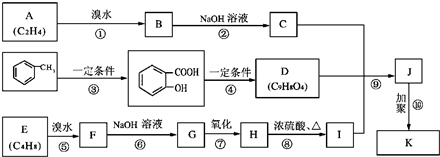
其中G无酸性,H、I有酸性;D可与NaHCO3溶液作用生成气体,并遇FeCl3溶液不显紫色;K的分子式为(C15H16O6)n.
请完成下列各题:
(1)反应⑥的反应类型为
(2)写出结构简式:E
 .
.
(3)写出下列反应的化学方程式:
B→C:
 .
.
H→I:
 .
.
(4)写出I的属于链状酯类且其核磁共振氢谱图中有三个吸收峰的同分异构体的结构简式 、
、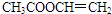 、
、
 、
、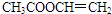 、
、 .(任写2个)
.(任写2个)
查看习题详情和答案>>
 合成一种药物K,其合成路线设计如下:
合成一种药物K,其合成路线设计如下:
其中G无酸性,H、I有酸性;D可与NaHCO3溶液作用生成气体,并遇FeCl3溶液不显紫色;K的分子式为(C15H16O6)n.
请完成下列各题:
(1)反应⑥的反应类型为
水解反应(或取代反应)
水解反应(或取代反应)
,反应⑨的条件是浓硫酸、加热
浓硫酸、加热
.(2)写出结构简式:E
CH2=C(CH3)2
CH2=C(CH3)2
,K

(3)写出下列反应的化学方程式:
B→C:


H→I:


(4)写出I的属于链状酯类且其核磁共振氢谱图中有三个吸收峰的同分异构体的结构简式
 、
、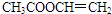 、
、
 、
、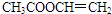 、
、
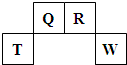 (2009?福建)短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等.
(2009?福建)短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等.请回答下列问题:
(1)T的原子结构示意图为


(2)元素的非金属性为(原子的得电子能力):Q
弱于
弱于
W(填“强于”或“弱于”).(3)W的单质与其最高价氧化物的水化物浓溶液共热能发生反应,生成两种物质,其中一种是气体,反应的化学方程式为
S+2H2SO4(浓)
3SO2↑+2H2O
| ||
S+2H2SO4(浓)
3SO2↑+2H2O
.
| ||
(4)原子序数比R多1的元素是一种氢化物能分解为它的另一种氢化物,此分解反应的化学方程式是
2H2O2
2H2O+O2↑
| ||
2H2O2
2H2O+O2↑
.
| ||
(5)R有多种氧化物,其中甲的相对分子质量最小.在一定条件下,2L的甲气体与0.5L的氧气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成的R的含氧酸盐的化学式是
NaNO2
NaNO2
.(6)在298K下,Q、T的单质各1mol完全燃烧,分别放出热量akJ和bkJ.又知一定条件下,T的单质能将Q从它的最高价氧化物中置换出来,若此置换反应生成3molQ的单质,则该反应在298K下的△H=
(3a-4b)kJ?mol-1
(3a-4b)kJ?mol-1
(注:题中所涉单质均为最稳定单质).