摘要:化学平衡常数: (1)概念:对于一定条件下的可逆反应.达到化学平衡时.生成物浓度的乘幂的乘积与反应物浓度的乘幂的乘积之比为一常数.记作Kc.称为化学平衡常数. (2)数学表达式: 如果反应物和生成物均为气体.当达到化学平衡时.将由各物质平衡分压算得的平衡常数称为压强平衡常数.即 浓度平衡常数和压强平衡常数均称为化学平衡常数. (3)意义:平衡常数的大小化学反应可能进行的程度,平衡常数的数值越大.说明反应进行得越完全. (4)影响因素:只与温度有关.而与浓度无关.
网址:http://m.1010jiajiao.com/timu_id_4426265[举报]
为了减少CO对大气的污染,某研究性学习小组拟研究CO和H2O反应转化为绿色能源H2,已知:2CO(g)+O2(g)═2CO2(g)△H=-566KJ/mol 2H2(g)+O2(g)═2H2O(g)△H=-483.6KJ/mol H2O(g)═H2O(l)△H=-44.0KJ/mol
(1)1mol氢气燃烧生成液态水时放出的热量为
(2)写出CO和 H2O(g)作用生成CO2和H2的热化学方程式 .
(3)往1L体积不变的容器中加入0.200molCO和1.00molH2O(g),在t℃时反应并达到平衡,若该反应的化学平衡常数K=1,则t℃时CO的转化率为 ;反应达到平衡后,升高温度,此时平衡常数将 (填“变大”、“变小”或“不变”),平衡将向 (填“正”或“逆”)反应方向移动.
(4)H2是一种理想的绿色能源,可作燃料电池;若该氢氧燃料电池以KOH为电解质溶液,其负极的电极反应式是 .
查看习题详情和答案>>
(1)1mol氢气燃烧生成液态水时放出的热量为
(2)写出CO和 H2O(g)作用生成CO2和H2的热化学方程式
(3)往1L体积不变的容器中加入0.200molCO和1.00molH2O(g),在t℃时反应并达到平衡,若该反应的化学平衡常数K=1,则t℃时CO的转化率为
(4)H2是一种理想的绿色能源,可作燃料电池;若该氢氧燃料电池以KOH为电解质溶液,其负极的电极反应式是
合成气的主要成分是一氧化碳和氢气,可用于合成二甲醚等清洁燃料.从天然气获得合成气过程中可能发生的反应有:
①CH4(g)+H2O(g)?CO(g)+3H2(g)△H1=+206.1kJ/mol
②CH4(g)+CO2(g)?2CO(g)+2H2(g)△H2=+247.3kJ/mol
③CO(g)+H2O(g)?CO2(g)+H2(g)△H3

请回答下列问题:
(1)在一密闭容器中进行反应①,测得CH4的物质的量浓度随反应时间的变化如图1所示.反应进行的前5min内,v(H2)=
(2)如图2所示,在甲、乙两容器中分别充入等物质的量的CH4和CO2,使甲、乙两容器初始容积相等.在相同温度下发生反应②,并维持反应过程中温度不变.已知甲容器中CH4的转化率随时间变化的图象如图3所示,请在图3中画出乙容器中CH4的转化率随时间变化的图象
 .
.
(3)反应③中△H3=
此时反应③中正、逆反应速率的关系式是
a.v(正)>v(逆) b.v(正)<v(逆) c.v(正)=v(逆) d.无法判断.
查看习题详情和答案>>
①CH4(g)+H2O(g)?CO(g)+3H2(g)△H1=+206.1kJ/mol
②CH4(g)+CO2(g)?2CO(g)+2H2(g)△H2=+247.3kJ/mol
③CO(g)+H2O(g)?CO2(g)+H2(g)△H3

请回答下列问题:
(1)在一密闭容器中进行反应①,测得CH4的物质的量浓度随反应时间的变化如图1所示.反应进行的前5min内,v(H2)=
0.3mol/(L?min)
0.3mol/(L?min)
;10min时,改变的外界条件可能是升高温度
升高温度
.(2)如图2所示,在甲、乙两容器中分别充入等物质的量的CH4和CO2,使甲、乙两容器初始容积相等.在相同温度下发生反应②,并维持反应过程中温度不变.已知甲容器中CH4的转化率随时间变化的图象如图3所示,请在图3中画出乙容器中CH4的转化率随时间变化的图象


(3)反应③中△H3=
-41.2kJ/mol
-41.2kJ/mol
.800℃时,反应③的化学平衡常数K=1.0,某时刻测得该温度下的密闭容器中各物质的物质的量见下表:| CO | H2O | CO2 | H2 |
| 0.5mol | 8.5mol | 2.0mol | 2.0mol |
a
a
(填代号).a.v(正)>v(逆) b.v(正)<v(逆) c.v(正)=v(逆) d.无法判断.
(2010?梅州一模)合成气的主要成分是一氧化碳和氢气,可用于合成二甲醚等清洁燃料.
请回答下列问题:
(1)在一密闭容器中进行反应CH4(g)+H2O(g)?CO(g)+3H2(g)△H1=+206.1kJ/mol,测得CH4的物质的量浓度随反应时间的变化如图1所示.反应进行的前5min内,v(H2)=
(2)如图2所示,在甲、乙两容器中分别充入等物质的量的CH4和CO2,使甲、乙两容器初始容积相等.在相同温度下发生反应CH4(g)+CO2(g)?2CO(g)+2H2(g)△H2=+247.3kJ/mol,并维持反应过程中温度不变.已知甲容器中CH4的转化率随时间变化的图象如图3所示,请在图3中画出乙容器中CH4的转化率随时间变化的图象.
(3)反应CO(g)+H2O(g)?CO2(g)+H2(g)△H3=-41.2kJ/mol在800℃时的化学平衡常数K=1.0,某时刻测得该温度下的密闭容器中各物质的物质的量见下表:
此时反应中正、逆反应速率的关系式是
a.v(正)>v(逆) b.v(正)<v(逆) c.v(正)=v(逆) d.无法判断.
查看习题详情和答案>>

请回答下列问题:
(1)在一密闭容器中进行反应CH4(g)+H2O(g)?CO(g)+3H2(g)△H1=+206.1kJ/mol,测得CH4的物质的量浓度随反应时间的变化如图1所示.反应进行的前5min内,v(H2)=
0.3mol/(L?min)
0.3mol/(L?min)
;10min时,改变的外界条件可能是升高温度或充入水蒸气
升高温度或充入水蒸气
.(2)如图2所示,在甲、乙两容器中分别充入等物质的量的CH4和CO2,使甲、乙两容器初始容积相等.在相同温度下发生反应CH4(g)+CO2(g)?2CO(g)+2H2(g)△H2=+247.3kJ/mol,并维持反应过程中温度不变.已知甲容器中CH4的转化率随时间变化的图象如图3所示,请在图3中画出乙容器中CH4的转化率随时间变化的图象.
(3)反应CO(g)+H2O(g)?CO2(g)+H2(g)△H3=-41.2kJ/mol在800℃时的化学平衡常数K=1.0,某时刻测得该温度下的密闭容器中各物质的物质的量见下表:
| CO | H2O | CO2 | H2 |
| 0.5mol | 8.5mol | 2.0mol | 2.0mol |
a
a
(填序号).a.v(正)>v(逆) b.v(正)<v(逆) c.v(正)=v(逆) d.无法判断.
为了减少CO对大气的污染,某研究性学习小组拟研究CO和H2O反应转化为绿色能源H2.已知:
2CO(g)+O2(g)=2CO2(g)△H=-566kJ?moL-1
2H2(g)+O2(g)=2H2O(g)△H=-483.6KJ?moL-1
H2O (g)=H2O(l)△H=-44.0KJ?moL-1
(1)氢气的标准燃烧热△H=
(2)写出CO和H2O(g)作用生成CO2和H2的热化学方程式
(3)往 1L体积不变的容器中加入1.00mol CO和1.00mol H2O(g),在t℃时反应并达到平衡,若该反应的化学平衡常数K=1,则t℃时CO的转化率为
(4)为了提高CO的转化率,可采取的措施是
A.增大的CO浓度 B.增大的H2O(g)浓度 C.使用催化剂 D.降低温度
(5)H2是一种理想的绿色能源,可作燃料电池;若该氢氧燃料电池以KOH为电解质溶液,其负极的电极反应式是
查看习题详情和答案>>
2CO(g)+O2(g)=2CO2(g)△H=-566kJ?moL-1
2H2(g)+O2(g)=2H2O(g)△H=-483.6KJ?moL-1
H2O (g)=H2O(l)△H=-44.0KJ?moL-1
(1)氢气的标准燃烧热△H=
-285.8
-285.8
kJ?moL-1(2)写出CO和H2O(g)作用生成CO2和H2的热化学方程式
CO(g)+H2O(g)=H2(g)+CO2(g)△H=-41.2KJ?moL-1
CO(g)+H2O(g)=H2(g)+CO2(g)△H=-41.2KJ?moL-1
(3)往 1L体积不变的容器中加入1.00mol CO和1.00mol H2O(g),在t℃时反应并达到平衡,若该反应的化学平衡常数K=1,则t℃时CO的转化率为
50%
50%
;反应达到平衡后,升高温度,此时平衡常数将变小
变小
(填“变大”、“不变”或“变小”),平衡将向逆
逆
(填“正”或“逆”)方向移动(4)为了提高CO的转化率,可采取的措施是
BD
BD
.A.增大的CO浓度 B.增大的H2O(g)浓度 C.使用催化剂 D.降低温度
(5)H2是一种理想的绿色能源,可作燃料电池;若该氢氧燃料电池以KOH为电解质溶液,其负极的电极反应式是
H2-2e-+2OH-═2H2O
H2-2e-+2OH-═2H2O
.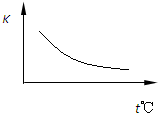 工业上制备H2的一种重要方法是:CO(g)+H2O(g)?CO2(g)+H2(g)△H=Q kJ?mol-1.已知该反应的平衡常数K与温度的关系如图所示.若在一固定的密闭容器中,850℃时发生上述反应,并测得容器内各物质的浓度(mol?L-1)随时间的变化关系如下表:
工业上制备H2的一种重要方法是:CO(g)+H2O(g)?CO2(g)+H2(g)△H=Q kJ?mol-1.已知该反应的平衡常数K与温度的关系如图所示.若在一固定的密闭容器中,850℃时发生上述反应,并测得容器内各物质的浓度(mol?L-1)随时间的变化关系如下表:| Kt℃ 时间/min |
CO(g) | H2O(g) | CO2(g) | H2(g) |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c4 |
| 4 | c1 | c2 | c3 | c4 |
(1)下列可以判断该反应达到化学平衡状态的是
A.单位时间内减少CO(g)的浓度等于生成CO2(g)的浓度
B.反应容器内的压强不发生变化
C.混合气体中H2(g)的浓度不再发生改变
D.氢气的生成速率等于水的消耗速率
(2)Q
(3)若在850℃时向反应容器中充入H2O(g),K值
(4)上表中c2为