摘要:34.在体积一定的密闭容器中放入3LR和5LQ气体.发生如下反应: 3R === 4X .反应完后.保持容器温度不变.测得混合气体的压强是原来的87.5%.则化学方程式中n的值为 .
网址:http://m.1010jiajiao.com/timu_id_4426127[举报]
(2013?浦东新区一模)能源短缺是人类面临的重大问题之一.甲醇是一种可再生能源,具有广泛的开发和应用前景.工业上合成甲醇一般采用以下反应:CO(g)+2H2(g)?CH3OH(g)+Q
下表所列数据是上述反应在不同温度下的化学平衡常数(K)
(1)在一定条件下将2mol CO和6mol H2充入2L的密闭容器中发生反应,5分钟后测得c(H2)=1.5mol/L,则此段时间内的反应速率(用CH3OH表达)
(2)由表中数据分析可知,Q
(3)在体积一定的密闭容器中,能说明该反应已处于化学平衡状态的是
a.V正(CO)=1/2V正(H2) b.混合气体的密度保持不变
c.反应体系中的热效应不再变化 d.c(CO):c(CH3OH)=1:1
(4)寻找到合适的催化剂是实现反应工业化的关键.该反应使用催化剂无法实现的目标是
a.提高单位时间内甲醇的产量 b.增大混合气体中甲醇的体积分数
c.缩短达到平衡所需时间 d.提高一氧化碳的转化率.
查看习题详情和答案>>
下表所列数据是上述反应在不同温度下的化学平衡常数(K)
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
0.15
0.15
mol/(L?min).(2)由表中数据分析可知,Q
>
>
0(填“>”、“<”或“=”).其它条件不变的情况下,若压缩容器的体积,则平衡向正反应方向
向正反应方向
移动(“向正反应方向”“向逆反应方向”或“不”),化学平衡常数K不变
不变
(填“增大”、“减小”或“不变”).(3)在体积一定的密闭容器中,能说明该反应已处于化学平衡状态的是
c
c
(填编号).a.V正(CO)=1/2V正(H2) b.混合气体的密度保持不变
c.反应体系中的热效应不再变化 d.c(CO):c(CH3OH)=1:1
(4)寻找到合适的催化剂是实现反应工业化的关键.该反应使用催化剂无法实现的目标是
bd
bd
(填编号).a.提高单位时间内甲醇的产量 b.增大混合气体中甲醇的体积分数
c.缩短达到平衡所需时间 d.提高一氧化碳的转化率.
在体积一定的密闭容器中,给定物质A、B、C的量,在一定条件下发生反应,建立如下化学平衡:aA(g)+bB(g)?xC(g),符合图1所示的关系(c%表示平衡混合气中产物C的百分含量,T表示温度,p表示压强).在图2中,Y轴是指( )
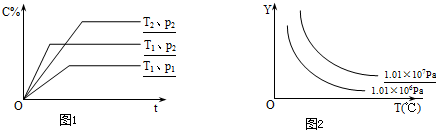
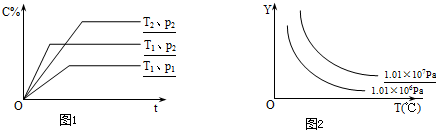
| A、反应物A的百分含量 | B、反应物B的平衡转化率 | C、平衡混合气的密度 | D、平衡混合气的总物质的量 |
